 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2025-08-18
2025-08-18
 837
837
引言
当全球生物医药产业驶入深水区,创新药“出海”已不仅是企业扩张的必选项,更是中国医药产业升级的战略支点。日本作为全球第三大医药市场,与中国药企在靶点开发、成本控制方面优势互补,成为中国创新药企出海的重要一站。
中国医药创新促进会始终致力于深化中日医药产业合作,并在医药创新领域取得了一系列实质性成果。为全面助力中国药监、生物技术公司、投资界深入了解日本药品监管法规、申报流程、沟通交流以及生产和检查等相关事宜,我会联合研发客、上海市生物医药科技产业促进中心以及泰格医药,共同开设“出海日本”专栏,特邀日本法规监管领域的资深专家发布专业性文章。撰稿人包括著名的药品开发及监管专家高野哲臣先生、东内祥浩先生和毛冬蕾女士。同时研发客主编毛冬蕾女士还将对日本政府、学术界以及中日两国业内专家进行访谈,共同探讨开发及监管热门话题。
中国药促会中日医药合作交流
联系人:马明尧
电话:13520846026
邮箱:mamy@phirda.com
撰文|东内祥浩(WaRA Consulting)
翻译|郁亮(北京恒创精成医药科技)
中文版翻译负责人|医药研发达人主编 高野哲臣(t2T Healthcare股份公司总裁兼首席执行官
•日本处方药注册申请准备包含申请用电子数据、eCTD、FD申请、网关系统四项关键内容,需掌握操作方法并预留充足准备时间。
•可以灵活运用PMDA咨询来确定哪些试验需要提交申请用电子数据。作为对象的临床试验的申请用电子数据,需以符合CDISC标准,确保监管部门提高审评的效率和准确性。
•日本规定申请人在提交注册申请前需与PMDA面谈,通过这一机制促进新药注册审评更加高效并达成目标期限内完成批准。
本连载的系列B将介绍日本药品监管制度的基本信息。这一期谈一谈处方药注册申请的准备工作。在日本,进行注册申请时需要用到各种工具,并且,包括熟练掌握这些工具的操作方法在内,需要预留充足的准备时间。
处方药注册申请需要的准备工作包括以下4项:
申请用电子数据(临床试验结果的电子数据)
电子通用技术文档(eCTD)
软盘(FD,Flexible Disk)申请
申请用电子数据系统(网关系统,Gateway System)
在本篇中,首先介绍这4个事项,之后作为第5个事项,将谈一谈新药注册申请计划事前面谈的相关情况。
1)申请用电子数据(临床试验结果的电子数据)及与提交相关的PMDA 咨询
在注册申请的 “对象品种” 的 “对象资料”中,要求提交临床试验结果的电子数据(以下简称“申请用电子数据”)作为注册申请书附件资料的一部分。
系列 B 第 6 篇《日本处方药有哪些注册分类?》表 1 中的注册分类(1)~(7)、(9)、(9 之 2)的处方药属于被要求提交申请用电子数据的 “对象品种”。“对象资料”的范围,除了注册申请时被认为是用于支持有效性、安全性及用法用量的主要依据评价资料外,还包括为设定用法用量而需进行的药代动力学评价至关重要的试验或分析(例如,群体药代动力学分析等)相关的资料。
可以灵活运用PMDA咨询来确定哪些试验需要提交申请用电子数据。例如,在Ⅱ期临床试验结束后咨询中,虽然主要是针对Ⅲ期临床试验的设计进行咨询,但笔者同时也建议在确认用于注册申请的临床数据集是否充分的基础上,将需要注册申请时提交哪些试验的申请用电子数据也纳入咨询项目中。
作为对象的临床试验的申请用电子数据,需以符合临床数据交换标准协会(Clinical Data Interchange Standards Consortium,CDISC)标准的格式提交。
可以运用PMDA 咨询中的《新药申请电子数据提交相关咨询》渠道来确认申请用电子数据的具体提交内容。例如,在《药品申请用电子数据提交方法咨询》中,可就拟提交的电子数据的存储方法、提交方式等(包括数据制作流程、格式、数据集、定义文件、解析程序等内容)进行咨询并获取建议。需在Ⅲ期临床试验结束、数据库锁定、依据解析结果完成最终报告之后、提交注册申请前开展该咨询,因此必须慎重考量开展咨询的时间。否则,有可能导致申请延迟。
2)eCTD(Electronic Common Technical Document)
处方药的注册申请资料需要通过电子通用技术文档(eCTD)进行提交。在日本,2003 年发布了《关于通用技术文档的电子化格式》的通知,其中规定了模块2至模块5的编制方法。随后在2004年又发布了《关于通用技术文档电子化格式的处理办法》的通知,明确了模块1的格式及eCTD的提交方法。据此,在日本,模块1至模块5的所有 CTD 模块均需通过eCTD进行提交。
eCTD有不同版本。此前的eCTD版本为3.2.2,今后将升级为 4.0 版本。由于4.0版本的格式与3.2.2版本差异较大,需要做好充分的准备工作以应对变更。在日本,自2022年4月起已开始受理4.0版本的注册申请,目前处于过渡期,仍可提交3.2.2版本的申请。但过渡期将于2026年3月结束,此后必须以4.0版本进行申请。欧美地区对4.0版本的强制使用时间分别为欧盟2027年、美国FDA 2029 年,因此欧美外资制药企业向日本提交申请时,需要比在其本国更早为日本申请准备4.0版本的相关材料,这成为了一个需要注意的问题。
3)FD(Flexible Disk, 软盘)申请
CTD 模块1.2中包含的注册申请书模板是固定的,需要从厚生劳动省(MHLW)的网站下载免费的FD申请软件(该名称源于其开发之初,当时注册申请书的记录媒介为软盘(FD);如今虽已不再使用软盘,但这一名称仍被保留),并按照软件界面提示填写必要事项,以完成注册申请书的填写。
以下是相当于注册申请书第一页的输入项目界面的示例。
图1 FD申请软件的画面示例
4)申请用电子数据系统(Gateway System, 网关系统)
在上述 “(1)申请用电子数据” 中,对于属于需要提交申请用电子数据的品种(注册分类(1)~(7)、(9)、(9 之 2)),需要在线提交注册申请书等材料。此时所使用的系统称为“申请用电子数据系统(网关系统)”,而该系统的使用则被称为“网关申请”。
使用网关系统时,需事先为系统使用人员获取个人证书,即从指定的认证机构获取个人电子证书。也就是说,个人电子证书仅由PMDA指定的认证机构发行,而网关系统采用的机制是仅允许已注册该个人证书的电脑终端进行访问。此外,该网关系统除用于注册申请外,也可以用于在PMDA咨询中提交咨询资料、接收与 PMDA之间的问询事项以及提交相关回应。
5)新药注册申请计划事前面谈
作为旨在缩短新药总审评时间的措施之一,规定在提交注册申请前,由申请计划人与PMDA进行面谈,就审评期间的各活动前后所需开展的应对工作进行相互确认。面谈需在计划提交注册申请的大致3个月前至1个月前开展。面谈免费,在PMDA内的会议室进行,时长为30分钟至1小时以内。
面谈事项如下所示,不过,若有其他希望咨询的事项,也可以在申请表中写明。
1) 审评时间表
①计划提交注册申请的时间
②提交注册申请时所需的送达资料份数及提交时间
③按照标准时间线推进时,首次面谈、发出重要问询事项、专家讨论、目标药事审议会各分会、批准的预计时间(关于审评流程的详细内容,将在系列 B 续篇中说明)
④长期治疗的临床试验最终报告的提交时间
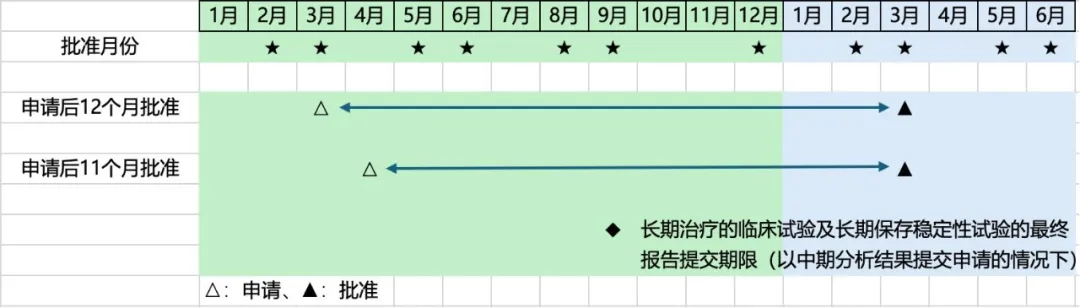
在日本,对于因治疗需求而预计需长期给药的新药,要求提交长期治疗的临床试验(给药1年)的结果作为注册申请所需资料。但为了尽可能早日批准新药,MHLW允许在长期治疗的临床试验实施过程中,基于中期分析结果(所有病例中完成6个月以上给药的数据)提交注册申请(由此可使申请时间提前约6个月)。在这种情况下,需在审评期间提交长期治疗的临床试验的最终报告,其提交期限要求最晚在总审评时间目标值的 6 个月前(参见笔者精选信息 8)。
⑤进行中的长期保存稳定性试验的试验结果报告的提交时间
关于稳定性试验中的长期保存试验,可以使用进行中的试验数据进行注册申请,前提是申请后需补充提交该试验的数据。最终报告需最晚在总审评时间目标值的 6 个月前提交。
⑥其他补充资料的提交时间等
2)关于 GMP 符合性检查的确认(参照系列 B 第 1 篇《日本药监部门的全面介绍》、第 2 篇《聚焦日本药品监管法规:药事法、药械法》)
①GMP 符合性检查的申请时间
②GMP 符合性检查的实施时间
③验证的实施时间
3)关于可靠性检查的确认(参照系列B第1篇《日本药监部门的全面介绍》)
①海外的注册申请情况及海外监管部门的检查情况
可靠性检查的实施时间及对象试验(临床试验为GCP检查对象,但具体纳入检查的临床试验通常在注册申请后确定。此外,需注意的是,由于中国是OECD非成员国且未加入数据互认协议(MAD,Mutual Acceptance of Data),因此即使是在中国NMPA认证的GLP机构实施的GLP研究,也会成为PMDA的GLP检查对象。)
②日本国内试验中电子记录(电子病例报告表等)的使用情况
笔者精选信息8
新药注册申请计划事前面谈
面谈申请表中需填写计划提交注册申请的时间、活性成分的通用名称、给药途径及剂型、计划申请的适应症、注册分类、以往 PMDA 咨询的类型及实施日期等信息。
PMDA的审评部门设有总审评时间的目标值,标准审评品种为12个月,优先审评品种为9个月。在面谈申请表中告知计划提交注册申请的时间后,对于标准审评品种,该时间点的12个月后便成为PMDA审评部门的目标批准月份。例如,若在某一年的3月提交注册申请,次年3月即为目标批准月份;但如果在4月提交注册申请,由于次年4月并非批准月份,为遵守总审评时间12个月的目标值,就需在3月完成批准,这种情况下审评时间为 11 个月。另外,根据面谈中告知的目标值,还可以明确长期治疗的临床试验及稳定性试验中长期保存试验的最终报告提交期限(目标批准月份的 6 个月前)。
PMDA将总审评时间的目标值视为极为重要的目标,所有的注册申请中,约80%都能达成这一目标值。
不过,审评时间的长短并非仅取决于PMDA。如果申请人未能在约定日期前对PMDA提出的问询事项作出回应,就可能导致审评时间延长,使得PMDA无法在既定的目标批准月份内完成批准。必须牢记,问询事项回应提交的延迟,不仅会造成批准时间、上市时间的推迟,还会阻碍PMDA达成目标,产生双重乃至三重的不良影响。
在新药注册申请计划事前面谈中,根据计划申请时间PMDA会告知目标批准月份,这一信息对企业开展销售准备等工作大有帮助。
下期预告
Next Preview
预计于2025年8月下旬或9月上旬出版的第19期是系列A《日本的临床试验和药品市场》第八篇将由高野哲臣撰写,他将介绍日本DCT的现状。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 38
38

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 38
38

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 40
40