 产业资讯
产业资讯
 药明康德
药明康德  2025-08-22
2025-08-22
 592
592
编者按:2025年,药明康德迎来创立25周年的重要里程碑。值此契机,我们向所有与我们共同书写产业变革篇章的科学家、医药人和投资者致以衷心感谢与诚挚敬意,也特别推出“致敬时代”系列,回顾全球同仁如何借助科学与合作的力量,不断拓展治疗边界、改善患者命运。
四分之一个世纪的坚守,只为加速每一款新药的诞生。下一个25年,我们将继续心怀感恩与敬畏,依托独特的CRDMO模式,与全球伙伴携手同行,共赴健康未来。
考古证据显示,早在新石器时代,人类已经有了头骨钻孔技术。纵观人类历史,钻孔术曾被用于治疗脑部肿块导致的慢性头痛、颅内压升高、癫痫以及颅脑创伤等。
随着医学的发展,人们逐渐认识到,头痛难忍、癫痫发作、视力受损、出现幻觉、患病后不久即离世的这一系列表现,有多种可能的病因,其中一种就是恶性脑肿瘤。如今,颅脑外科手术已成为恶性脑肿瘤的主要治疗方法,还发展出放化疗、靶向药物治疗等多种疗法。
恶性脑肿瘤俗称“脑癌”,其中高达80%都是脑胶质瘤,全球每年每10万人中约有5~6例新发病例。脑胶质瘤起源于脑神经胶质细胞,具有高致残率、高复发率的特点,即使手术也很难彻底切除,术后容易复发甚至进一步恶化。长期以来,脑胶质瘤患者的生存预后并不理想,直到近20多年才在化疗和靶向治疗方面取得突破性进展,多款新药接连问世,为患者带来曙光。药明康德也很荣幸能与产业同道一起乘风破浪,载着患者驶向治愈的彼岸。

图片来源:123RF
跨越两个世纪的初步探索
历史上最早有记录的脑胶质瘤死亡案例描述可以追溯到19世纪。19世纪中叶,被誉为“病理学之父”的鲁道夫·维尔肖(Rudolf Virchow)首次从病理学上描述了“神经胶质瘤”的概念,指出这个病起源于大脑的神经胶质细胞。
1884年,在英国医生休斯·贝内特(Hughes Bennett)的帮助下,解剖学家里克曼·戈德利(Rickman Godlee)进行了世界上第一例脑胶质瘤切除手术。那是一名25岁男性患者,有进行性癫痫发作、头痛、难治性呕吐等症状。虽然患者最初康复了,但局限于当时的手术和护理技术,术后不到1个月就死于脑膜炎和脑疝等并发症。19世纪末,更多颅脑外科手术成功开展,颅内压管理的改善让术后早期死亡率从50%降至6%,为现代脑外科手术的发展奠定了基础。
20世纪,人们陆续发现了多种脑胶质瘤亚型,疾病分类越来越细。1979年,世界卫生组织(WHO)建立了第一版中枢神经系统肿瘤组织学分类,如今已更新至第五版。现行分类标准中,1级胶质瘤通常为良性、可通过手术完全切除达到治愈,很少演变为更高级别的病变;但2级或3级胶质瘤具有侵袭性,可进展为更高级别病变、预后较差;而4级的胶质母细胞瘤(曾被称为“多形性胶质母细胞瘤”)侵袭性更强,中位生存期仅为12-15个月,5年生存率不到10%(也就是5年死亡率在90%以上)。

图片来源:123RF
同一时期,得益于外科手术、影像学检查等技术的发展,胶质瘤的诊断与治疗方法不断更新。20世纪50年代引入放疗后,胶质母细胞瘤患者的存活率比单纯接受手术的患者提高了一倍。尽管取得了这些进展,胶质瘤患者的预后依然较差,在病因方面的探索也依然迷雾重重。
直到21世纪,新型化疗药替莫唑胺和多款靶向药物出现,才打破了胶质瘤的治疗瓶颈。
脑胶质瘤化疗:开启“替莫唑胺时代”
从1960年开始,人们曾尝试用多种烷化剂类抗肿瘤化疗药物治疗脑胶质瘤,但无论是单一还是联合化疗,都无法显著延长患者的生存和无复发时间。尤其对于恶性程度较高的脑胶质瘤(多形性胶质母细胞瘤和间变性星形细胞瘤),即使采用非常积极的手术、放化疗联合治疗,也无法让患者的中位总生存期达到1年。
直到20世纪80年代,在英国癌症研究中心(Cancer Research UK)前身“癌症研究运动”(Cancer Research Campaign)与英国医药公司May & Baker的共同资助下,英国阿斯顿大学(Aston University)的马尔科姆·史蒂文斯(Malcolm Stevens)教授团队开发出了新型化疗药替莫唑胺(temozolomide,简称TMZ)。这是一种简洁而稳定的药物分子,口服后可迅速吸收,而且不同于其他化疗药物的是,它相对容易穿透血脑屏障、从而进入大脑发挥作用。很快,科学家在1期临床试验中发现,替莫唑胺对脑胶质瘤具有抗肿瘤活性。
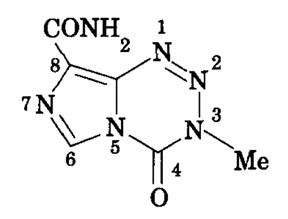
▲替莫唑胺的化学结构(图片来源:参考资料[10])
90年代初,当时的先灵葆雅公司(Schering-Plough,后并入默沙东公司)获得了替莫唑胺在全球绝大部分区域的开发经营权,进一步在全球开展临床试验。
1999年,基于多项积极的2期试验结果,替莫唑胺先后获欧盟EMEA(现名为欧洲药品管理局)和美国FDA加速批准上市(商品名分别为Temodal、Temodar)。EMEA首次批准的适应症为用于经标准治疗后出现复发或进展的3岁及以上恶性胶质瘤(如多形性胶质母细胞瘤或间变性星形细胞瘤)患者,以及新确诊的多形性胶质母细胞瘤成年患者;FDA首次批准的适应症为用于难治性间变性星形细胞瘤成人患者。从此,脑胶质瘤的治疗进入“替莫唑胺”时代。
几年后,一项具有里程碑意义的3期临床研究结果出炉:在新确诊的多形性胶质母细胞瘤患者中,与单独放疗相比,放疗联合替莫唑胺化疗具有显著优势,中位生存期达到了14.6个月,超过1年;后续公布的结果还显示,肿瘤完全切除后进行放化疗的患者,中位生存期更是延长到了18.3个月。2005年3月,FDA批准替莫唑胺的新适应症——用于与放疗相结合,治疗新确诊的胶质母细胞瘤患者。2007年,替莫唑胺也在中国获批上市(商品名:泰道),用于常规治疗后复发或进展的多形性胶质母细胞瘤或间变性星形细胞瘤患者。
脑胶质瘤靶向疗法:在百花齐放中萌芽
尽管化疗带来了显著进步,患者仍然期望获得更好的治疗结局。
从20世纪90年代到21世纪初,随着分子生物学和遗传学研究的不断深入,科学家们发现了与肿瘤发生、发展相关的驱动性基因、分子标志物和信号通路,针对特定分子或通路、毒性更小的各类肿瘤靶向治疗药物也应运而生。
然而,脑胶质瘤领域的靶向疗法研究却面临更多挑战。因为这类肿瘤的发生和发展由很多条信号通路驱动、它们之间构成了复杂、互补的动态网络,很难确定哪个靶点更为核心,只能逐个尝试。
彼时,已在其他肿瘤中得到验证的血管内皮生长因子(VEGF)也是候选靶点之一,而研究发现,抑制VEGF也确实与胶质母细胞瘤生长减缓、肿瘤血管生成减少有关。据此,罗氏(Roche)旗下的基因泰克(Genentech)公司开始尝试在临床试验中将此前已斩获多个肿瘤适应症、靶向抑制VEGF受体的贝伐珠单抗(bevacizumab)用于治疗胶质母细胞瘤患者。2009年,基于2期研究的积极结果,贝伐珠单抗获FDA加速批准(商品名:Avastin),用于既往治疗后进展(复发性)的胶质母细胞瘤成人患者。贝伐珠单抗也成为首个获FDA批准用于复发性胶质母细胞瘤的靶向治疗药物。在后续更多证据的支持下,该适应症于2017年获FDA完全批准。2020年,贝伐珠单抗也在中国获批用于治疗复发性胶质母细胞瘤。
为了更进一步改善患者的总生存期,科学家认为,仅靶向VEGFR这一条路径,可能不足以抑制脑胶质瘤的进展,还需继续探索其他有潜力的靶点。

图片来源:123RF
同一时期,由诺华(Novartis)开发的靶向抗癌药物——哺乳动物雷帕霉素靶点(mTOR)通路抑制剂依维莫司(everolimus),被发现与室管膜下巨细胞星形细胞瘤的体积和发作频率显著减少有关,在某些情况下可能是神经外科切除的潜在替代方案。2010年,依维莫司获FDA加速批准(商品名:Afinitor),用于治疗不适合根治性手术切除的结节性硬化症相关的室管膜下巨细胞星形细胞瘤患者。2014年,依维莫司也在中国获批室管膜下巨细胞星形细胞瘤适应症。
BRAF也是该领域一个有潜力的靶点。由诺华开发、从2014年起陆续获批用于多种BRAF V600E突变实体瘤的BRAF抑制剂达拉非尼(dabrafenib)与MEK抑制剂曲美替尼(trametinib)联合疗法,近年在BRAF突变的低级别胶质瘤中也表现出不错的疗效。2023年,该联合疗法获FDA批准扩大适应症,用于治疗1岁及以上需要全身治疗的BRAF V600E突变的低级别胶质瘤儿童患者。2024年,还有一款由Day One Biopharmaceuticals与武田(Takeda)、Sunesis Pharmaceuticals共同开发的小分子药物tovorafenib获FDA批准上市(商品名:Ojemda),该药是可穿越血脑屏障的高特异性泛RAF激酶抑制剂,用于治疗携带BRAF重排(包括融合)变异或BRAF V600E突变的6个月及以上复发或难治性儿童低级别脑胶质瘤患者。益普生(Ipsen)获得了该药在美国以外地区的开发授权许可。
针对脑胶质瘤“专属”靶点的新药崭露头角
随着越来越多的脑胶质瘤相关基因变异被挖掘,也催生出多款针对脑胶质瘤特定突变的靶向疗法。
2009年,美国杜克大学医学中心儿童脑肿瘤基金会研究所的研究团队发现,在2级和3级胶质瘤以及由前者进展而来的4级胶质母细胞瘤中,大多数肿瘤都携带异柠檬酸脱氢酶1或2(IDH1和IDH2)基因突变。IDH1和IDH2是代谢酶,当IDH1和IDH2基因突变后,表达异常的IDH则可引发细胞生长失控,变为“疯长”的癌细胞。由此,科学家开始着手开发针对IDH突变的新型靶向疗法。

图片来源:123RF
由Agios Pharmaceuticals最初开发、后授权给了施维雅(Servier Pharmaceuticals)的口服小分子药物vorasidenib就是一款IDH双重抑制剂,它能抑制突变的IDH1/2蛋白活性、从而抑制肿瘤生长,而且具有脑渗透性。3期临床研究显示,vorasidenib能让IDH1/2突变2级胶质瘤患者获得长达2年以上病情稳定、肿瘤逐渐缩小、不需要二次干预的高质量生活。2024年,vorasidenib获FDA批准上市(商品名:Voranigo),适用于携带IDH1或IDH2突变的2级星形细胞瘤或少突胶质细胞瘤的12岁及以上成人和儿童患者的手术(包括活检、次全切除术或全切除术)后治疗。这是FDA批准的首款用于IDH突变脑胶质瘤患者群体的靶向疗法,也是胶质瘤领域近25年来的重大突破,具有里程碑意义。
2012年,有文献报道在弥漫性中线胶质瘤中发现了一种新变异类型——H3 K27M突变,该突变与胶质瘤患者较差的预后有关。针对这一突变类型,由Chimerix最初开发、后被Jazz Pharmaceuticals收购的新药dordaviprone表现出不俗的潜力。就在今年8月,dordaviprone获FDA加速批准上市(商品名:Modeyso),用于治疗1岁及以上、携带H3 K27M突变且在既往治疗后疾病进展的弥漫性中线胶质瘤成人和儿童患者。这是FDA批准的首个针对H3 K27M突变弥漫性中线胶质瘤的全身性疗法。
上述两款新型靶向药为脑胶质瘤患者提供了“专属”的靶向治疗选择,重塑了治疗格局。
更多脑胶质瘤新疗法蓄势待发
近5年来,其它获批治疗脑胶质瘤的新药还包括在日本获批、由第一三共(Daiichi Sankyo)与东京大学共同研发的溶瘤病毒疗法teserpaturev;以及在中国获批、由浦润奥生物开发的MET抑制剂伯瑞替尼。
总的看来,过去20多年中,美国FDA批准了至少8款脑胶质瘤相关疗法,其中大部分都是靶向药物。药明康德很高兴能为其中多款疗法赋能、助力这些创新疗法的问世,造福病患。
为更好地满足脑胶质瘤的治疗需求、达到更高的治疗目标,产业圈仍在深入探索。当下还有近400款针对脑胶质瘤的新疗法正处于积极的临床研究中,有望在未来造福更多患者。其中有数十款已进入3期临床阶段,涵盖小分子靶向药、“合成致死”疗法、放射性同位素偶联药物(RDC)、免疫检查点抑制剂、溶瘤病毒等多种类型,比如由Telix Pharmaceuticals开发、靶向LAT-1的放射性同位素偶联药物TLX101(131I-iodofalan),今年上半年公布的2期试验结果显示,复发性高级别胶质瘤患者自接受TLX101治疗起的中位总生存期达到12.4个月,自确诊起为32.2个月,接近3年。相比过往研究中仅接受外放射治疗(EBRT)的复发性胶质母细胞瘤患者的生存数据(9.9个月),这一疗法让生存期提高了3倍多。

图片来源:123RF
时过境迁,物转星移,这类恶性疾病的治疗方案也在不断革新。但不变的,是人类对延续生命的渴望,是整个医药产业的传承与创新。
作为创新的赋能者,成立25年来,药明康德很高兴能助力全球合作伙伴,通过独特的一体化、端到端CRDMO模式,支持全球合作伙伴从药物发现(R)、开发(D)到商业化生产(M)各个阶段的需求,加速各类创新疗法的问世,造福病患。
最后,让我们再次向那些在脑胶质瘤治疗领域深耕不辍的英雄们致以崇高的敬意。药明康德也期待与业界同仁继续同行,解锁更多疾病的治愈密码。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 94
94

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 82
82

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 73
73