 产业资讯
产业资讯
 药时空
药时空  2025-08-22
2025-08-22
 352
352
8月20日,万泰生物、康希诺生物发布了2025年半年度报告。两家企业营收分别下降38.25%、26.00%;万泰生物继续亏损,净利润下降155.30%,康希诺生物则净亏损同比收窄94.02%。下面为两家企业的具体业绩情况。
1、万泰生物
2025年上半年,公司实现收入8.44亿元,同比下降38.25%;归属于母公司股东的净利润为-1.44亿元,同比下降155.30%。归属于母公司股东的扣非净利润为-2.43亿元,同比下降481.93%。营收下降主要是由于公司疫苗板块受市场调整、政府集采及九价HPV疫苗扩龄等影响,销售不及预期,疫苗板块收入较上年同期回落。
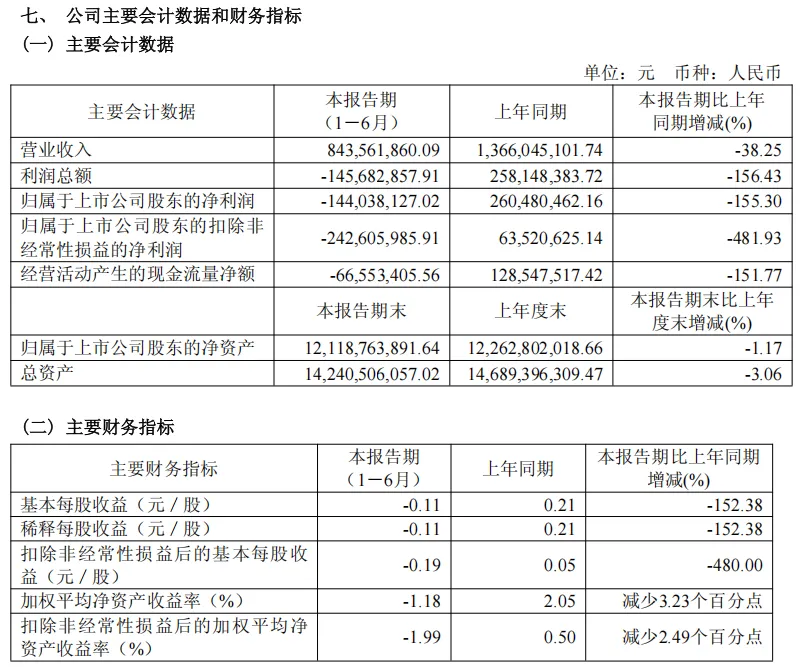
万泰生物的主营业务分为疫苗和体外诊断两大板块。在疫苗板块,作为国家部署的五条新冠疫苗研制技术路线之一的鼻喷流感病毒载体新冠疫苗已在国内获得紧急使用授权。同时,公司已构建了以HPV疫苗为核心的多元化管线布局。其中,公司的戊肝疫苗益可宁作为全球唯一的戊型肝炎疫苗,填补了该领域的空白;二价HPV疫苗馨可宁®已通过WHO-PQ
认证,并在海外摩洛哥、尼泊尔、泰国等23个国家和地区获得市场准入;九价HPV疫苗馨可宁®9于今年获得国家药品监督管理局批准上市,成为了国产首款、全球第二款获批的九价HPV疫苗,标志着我国成为继美国后第二个具备独立自主供应高价次HPV疫苗能力的国家。
目前,公司正在积极推动九价HPV疫苗的上市准备工作,已按既定计划有序推动批签发,并严格按各省级疫苗管理部门制定的招/补标以及准入规则推进工作。在此基础上,公司还在积极推进更具市场竞争力的第三代HPV疫苗,通过持续迭代产品进一步巩固其在HPV疫苗领域的领先地位,构建并维持在该领域的长期技术与产品优势。
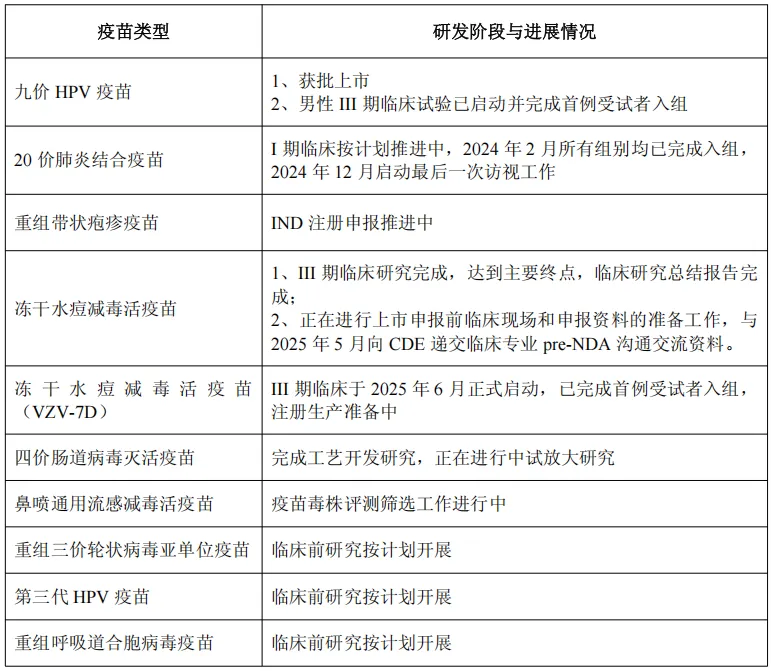
此外,公司在研的20价肺炎结合疫苗、重组带状疱疹病毒疫苗、重组三价轮状病毒亚单位疫苗、重组呼吸道合胞病毒疫苗、冻干水痘减毒活疫苗、冻干水痘减毒活疫苗(VZV-7D)和鼻喷通用流感疫苗等多个新管线均按计划有序推进中。以下为报告期内,公司疫苗管线研发进展:
国际市场方面,公司正通过参与全球疫苗免疫联盟(GAVI)市场和争取更多产品的PQ预认证,不断增强在国际疫苗市场的竞争力。通过不断开拓二价HPV疫苗及戊肝疫苗在多个国家的注册准入,截至本报告披露日,公司疫苗产品已获海外24个国家的上市许可,纳入9个国家免疫规划项目。对已获批上市国家积极推进政府公立招标准入以及自费市场的教育和推广渠道搭建,多方式、多渠道地推动国际市场的销售。同时,公司也在全力推进九价HPV
疫苗WHO
PQ认证进程,依托公司二价HPV疫苗已取得的国际化成果,构建更广阔的全球化网络,持续支持全球消除宫颈癌战略,持续挖掘更多国际市场机会,包括对欧美市场的长期探索。
2、康希诺生物
2025年上半年,康希诺生物实现营业收入3.82亿元,同比下降26.00%;归属于上市公司股东的净亏损为人民币0.13亿元,实现同比收窄94.02%。亏损收窄主要系四价流脑结合疫苗曼海欣®销售收入增长;集团获得了更多政府专项补助及国际专项资金的支持;集团疫苗产量的逐步提升,以及对产能结构的进一步优化等原因。
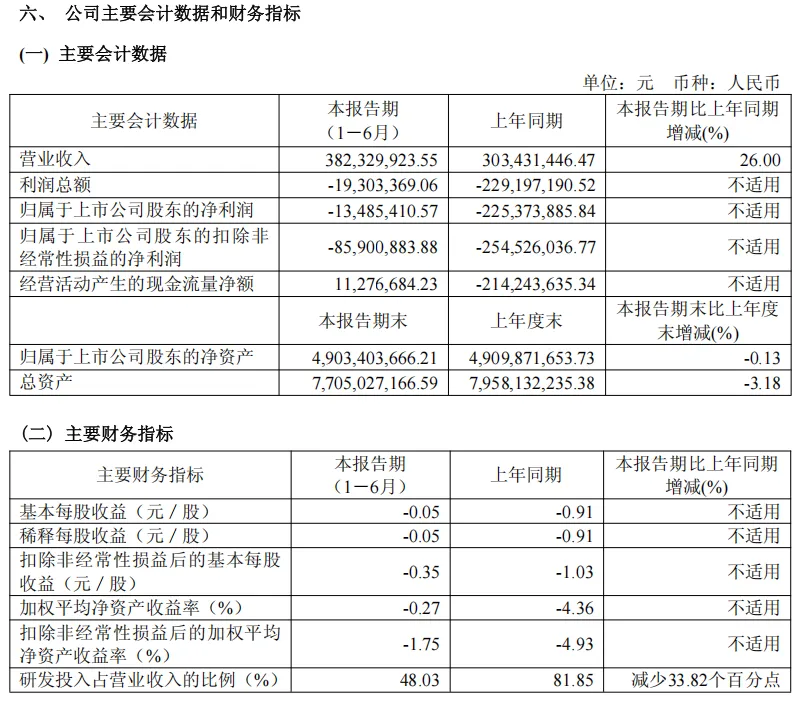
公司构建了五大技术平台,并形成了极具竞争力的产品管线,包括针对预防脑膜炎、肺炎、百白破、新冠肺炎、埃博拉病毒病、脊髓灰质炎、带状疱疹、结核病等10余种适应症的多款创新疫苗产品。
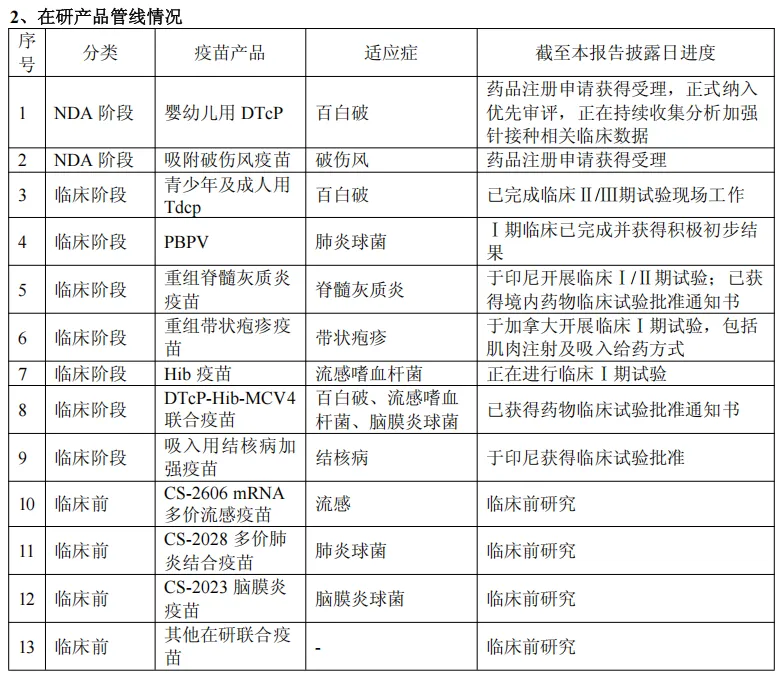
流脑疫苗:报告期内,随着流脑疫苗产品的推广和市场终端选择,两款流脑结合疫苗MCV4曼海欣®和 MCV2美奈喜®实现销售收入约36,367.48万元,同比增长38.43%。同时,MCV4的药品补充申请已获国家药品监督管理局受理,适用人群年龄范围拟由“3 月龄~3 周岁(47 月龄)儿童”扩大至“3 月龄~6 周岁(83 月龄)儿童”,以期为儿童提供更全面的保护,并进一步提升 MCV4 曼海欣®的市场渗透率。
13价肺炎结合疫苗:2025年6月,公司的PCV13i优佩欣®获得国家药品监督管理局下发的《药品注册证书》,该产品为公司肺炎产品组合中首个获得药品注册证书的产品,为公司更高价肺炎结合疫苗的研发奠定基础。
组分百白破疫苗产品组合:公司的婴幼儿组分百白破疫苗DTcP已完成受试者前三针基础免疫接种工作,于2024年12 月,其境内生产药品注册上市许可获得国家药品监督管理局出具受理通知书,公司后续将向监管机构适时提交婴幼儿用DTcP加强免疫相关数据。2025年2月,婴幼儿用DTcP已正式纳入优先审评品种。青少年及成人用组分百白破疫苗 Tdcp已完成Ⅲ期临床受试者入组。DTcP-Hib-MCV4联合疫苗正在进行Ⅰ期临床试验前的准备工作,预计年底前启动。吸附破伤风疫苗于2025年2月向国家药品监督管理局递交药品注册申请并获得受理。
重组脊髓灰质炎疫苗:2024年12月,该产品于印尼启动于特定年龄婴幼儿中的Ⅰ/Ⅱ期临床试验并完成Ⅰ期临床首例受试者入组;2025年7月,公司收到国家药品监督管理局核准签发的关于重组脊髓灰质炎疫苗的《药物临床试验批准通知书》。
吸入用结核病加强疫苗:2025年5月,该疫苗获得印度尼西亚食品药品监督管理局(BPOM)签发的临床试验批准。
国际市场方面,公司目前正在开展四价流脑结合疫苗的出海工作,主要以东南亚、中东、北非、南美为目标区域,推动注册和商业化工作。公司的MCV4已获得了印尼的注册证书,也正于印尼进行评价该疫苗在18-55岁人群中接种后的安全性和免疫原性的临床试验,以期扩大适用人群。公司也会同步结合未来13价肺炎结合疫苗及组分百白破疫苗组合的海外开拓目标,以公司丰富的产品管线为切入点,与合作方建立长期良好的战略合作关系,探索技术转移的合作模式,推进公司国际化进程。同时,公司也会视产品定位及研发进度,以WHO
PQ 认证为方向进行前期准备和筹划工作,探索国际组织采购产品的可行性;对于全球创新类产品,也会积极探讨于发达国家准入的可行性。

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 87
87

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 79
79

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 81
81