 会员动态
会员动态
 医药观澜
医药观澜  2025-08-29
2025-08-29
 1732
1732
8月27日,信达生物公布2025年度中期业绩和公司业务进展。
信达生物制药集团创始人、董事会主席、首席执行官俞德超博士表示,2025年上半年,信达生物交出了一份令人振奋的成绩单,双轮驱动与全球创新战略全面提速。公司的产品线扩充至16款药物,实现了收入和盈利的显著跃升。在创新端,多款具备全球化潜力的核心管线取得关键性概念验证数据,并逐渐迈入全球注册临床开发,标志着信达生物创新力的厚积薄发,也为全球化拓展夯实了根基。展望未来,公司将进一步稳固在肿瘤领域的领导地位,继续推动综合产品线商业化多元创新策略的探索和落地,并加快新一代创新管线的全球开发进程。信达生物将锚定“2030年5个管线进入全球3期临床研究”的战略目标,持续努力。

2025上半年,信达生物有多款产品获得重要进展,丰富了其产品矩阵:
肿瘤领域三款新品成功上市:ROS1抑制剂他雷替尼胶囊、第三代EGFR TKI 肺癌靶向药利厄替尼片、血液瘤非共价BTK抑制剂匹妥布替尼片;
慢病领域注入创新动力:PCSK-9抑制剂托莱西单抗注射液于2025年5月获得澳门药监局(ISAF)批准上市;替妥尤单抗N01注射液成为治疗甲状腺眼病(TED)的突破性创新药;针对GCG/GLP-1的双靶点减重药物玛仕度肽注射液另一项针对2型糖尿病的上市申请(NDA)正在NMPA审评中。
其他产品进展还包括:
信迪利单抗注射液:肾癌、结肠癌两项新增NDA审评中,肺癌新辅助3期研究进行中
玛仕度肽:糖尿病NDA审评中,新增第6和第7项临床3期研究(OSA、肥胖合并MAFLD),更多PoC研究进行中(青少年肥胖、MASH、心衰等);
匹康奇拜单抗:即将获批的银屑病强效长效IL-23p19生物制剂;临床3期研究探索治疗后撤药维持、IL-17响应不佳人群治疗潜力;
替妥尤单抗N01注射液:计划新开3期临床研究,探索治疗静止期甲状腺眼病,及头对头激素治疗甲状腺眼病的临床潜力。
IBI363(PD-1/IL-2α-bias):新一代IO疗法
- ASCO三项口头报告亮相,针对免疫治疗失败、冷肿瘤、PD-L1低表达均读出突破性PoC数据,展现出双免疫激活和长期生存获益的独特优势;
- 三项注册临床研究陆续开出:首个全球注册3期临床研究在中美启动,解决全球IO耐药肺鳞癌未满足需求;首个黑色素瘤关键2期临床研究已启动,挑战一线疗法Keytruda;首个后线肠癌注册3期临床研究即将启动;
- 持续拓宽适应症至一线疗法及更多癌种,包括一线肺癌,一线肠癌,肺癌新辅助,EGFR突变肺癌,铂耐药卵巢癌等治疗潜力
IBI343(CLDN18.2 ADC):胃癌、胰腺癌双注册临床,首个胃癌国际多中心3期临床研究进行中、首个胰腺癌3期注册临床研究启动、胰腺癌全球多中心3期临床研究规划中。该产品还获CDE突破性疗法、FDA快速审评通道多项资格
超十款创新管线陆续步入全球开发
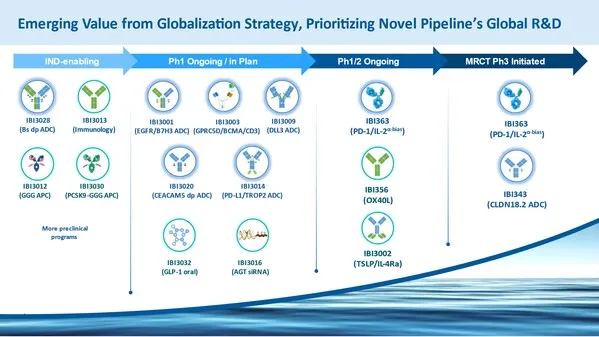
肿瘤:IBI3009(DLL3 ADC), IBI3001 (EGFR/B7H3 ADC),IBI3003(GPRC5D/BCMA/CD3),
IBI3005(EGFR/HER3 ADC), IBI3014(PD-L1/TROP2 ADC) ,IBI3020(CEACAM5双载荷ADC)等
自免:IBI356(靶向OX40L的免疫分子),IBI3002(TSLP/IL-4Rα双抗)等
心血管及代谢(CVM):IBI3016(AGT siRNA),IBI3032(口服小分子GLP-1)等。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 164
164

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 162
162

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 183
183