 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-09-02
2025-09-02
 863
863
8月29日,云顶新耀公布2025年中报:收入增长48%至4.46亿元,主要由于耐赋康®(布地奈德肠溶胶囊)及依嘉®(依拉环素)在已商业化市场上持续增长;亏损则由去年同期的6.32亿元减至2.50亿元。
业内最关心的是,无疑是其肾病大单品布地奈德肠溶胶囊的放量情况。此前,业内预测,布地奈德肠溶胶囊有望成为罕见的进入医保首年即达“十亿量级”的慢病创新药。
结合云顶新耀披露的公告,布地奈德肠溶胶囊今年上半年销售收入达人民币3.03亿元,同比增长81%,主要受制于上半年供应偏紧,不过已展现出强劲的患者需求,新患人数超2万名。
而在8月初扩产补充申请获批后,8月单月布地奈德肠溶胶囊销售收入就达到了惊人的5.20亿元。云顶新耀预测,该药全年销售额将达12亿-14亿元,2026年将高速增长至24亿-26亿元。
云顶新耀同时在公告中表示,基于布地奈德肠溶胶囊强劲的市场增长势头与依拉环素的稳健表现,对实现全年人民币16亿-18亿元的销售目标充满信心,并预计将在第四季度实现经营性现金流转正。
对于上半年的销售大增,云顶新耀在战略层面将其归功于“双轮驱动”:以开发高潜力蓝海市场的大单品商业化平台为基石、以自体生成CAR-T平台与mRNA肿瘤治疗性疫苗平台的自主研发与临床转化为引擎。
而“双轮驱动”战略也正在将云顶新耀向全球领先的Biopharma公司方向引领。
以大单品为基石
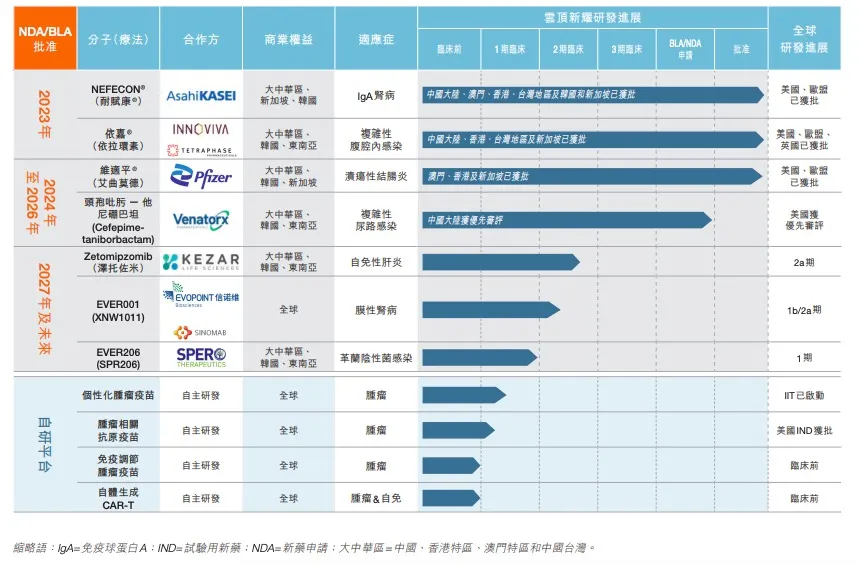
目前,云顶新耀已成功实现三款产品的商业化上市,分别是:布地奈德肠溶胶囊、依拉环素和艾曲莫德,顺利复盖肾病、感染性疾病及自身免疫性疾病等市场。
布地奈德肠溶胶囊作为全球首个对因治疗IgA肾病的药物,是靶向肠道黏膜B细胞的免疫调节剂。该药于2023年11月获得中国国家药品监督管理局(NMPA)批准用于治疗原发性lgA肾病,于2024年5月在中国大陆上市,同年11月被纳入国家医保药品目录。
凭借着患者群体庞大、产品疗效佳和当前“零有效竞争”的格局,布地奈德肠溶胶囊在商业化之路上狂奔。
今年1月,布地奈德肠溶胶囊开始执行医保新价格。患者可在定点医疗机构或定点药店购买,并享受医保报销价格。国家医保药品目录的正式实施让布地奈德肠溶胶囊进一步开始放量。
今年5月,布地奈德肠溶胶囊正式获得NMPA批准,由附条件批准转为完全批准,取消蛋白尿水平限制。而这也意味着布地奈德肠溶胶囊成为首个且唯一获得NMPA完全批准的IgA肾病对因治疗药物。
与此同时,布地奈德肠溶胶囊被纳入《中国成人IgA肾病及IgA血管炎临床实践指南(预审版本)》,推荐对有疾病进展风险的lgA肾病患者进行9个月的布地奈德肠溶胶囊对因治疗,不受蛋白尿水准的限制,以降低致病性IgA(Gd-IgA1)。
今年8月,云顶新耀宣布布地奈德肠溶胶囊扩产补充申请已正式获得NMPA批准。此次扩产获批将进一步提升该药的产能和产品供应,进而更高效地回应中国及亚洲地区持续增长的临床需求。
此外,布地奈德肠溶胶囊的补充申请也获得了中国台湾地区药政部门的正式批准,适用于罹患原发性免疫球蛋白A肾病(lgA肾病)且病情有恶化风险的成人病人,用以减缓肾功能下降。至此,该药已在云顶新耀复盖的所有授权区域实现完全批准,巩固了其在亚洲作为IgA肾病一线治疗基石的地位,推动IgA肾病治疗的标准化与规范化进程。
不难看出,通过进医保目录、适应症扩展、产能扩增,布地奈德肠溶胶囊在商业化方面登上了一个又一个“台阶”。
除布地奈德肠溶胶囊外,云顶新耀还成功实现了依拉环素和艾曲莫德的商业化。
依拉环素是全球首个氟环素类抗菌药物,用于治疗包括临床常见多重耐药菌在内的革兰阴性菌、革兰阳性菌、厌氧菌等所引起的感染。
目前,依拉环素已在美国、欧盟、英国、新加坡、中国大陆、中国香港和中国台湾地区被批准用于治疗复杂性腹腔内感染(cIAI)。
今年上半年,云顶新耀进一步提高了依拉环素在300家左右核心医院的渗透,使其在医院端纯销同比增长37%,并通过优化的合同销售组织(CSO)模式,扩大了该高级别抗菌药物的可及性。
半年报显示,今年上半年布地奈德肠溶胶囊和依拉环素这两款产品销售额达到4.46亿元。
艾曲莫德是一种每日一次口服的高选择性鞘氨醇-1-磷酸(S1P)受体调节剂。目前,该药已在美国、欧盟、加拿大、日本、澳大利亚新加坡、英国、瑞士、以色列、中国香港以及中国澳门等多个国家和地区获得新药上市批准。
今年8月,云顶新耀宣布中国台湾地区药政主管部门已正式受理艾曲莫德用于治疗中重度活动性溃疡性结肠炎(UC)患者的新药上市许可申请(NDA)。此外,NMPA也于2024年12月正式受理艾曲莫德的新药上市申请。云顶新耀透露,预计该药将于2026年上半年在中国大陆获批。
为了更好地供给产能,艾曲莫德位于嘉善工厂的生产建设项目已在今年2月启动。该项目总投资为7000万元,预计正式投产后艾曲莫德的年产能可达5000万片。云顶新耀表示,计划供应地区复盖包括中国大陆、中国香港、中国澳门、中国台湾、韩国以及新加坡在内的授权区域。
以自主研发为引擎
在商业化产品加速增长的同时,云顶新耀的在研产品也取得了不少进展。
其临床阶段产品管线中,VER001(希布替尼)用于治疗原发性膜性肾病的1b/2a期试验取得积极数据读出。
EVER001是新一代可逆共价布鲁顿酪氨酸激酶(BTK)抑制剂,可用于治疗多种自身免疫驱动的肾脏疾病,开发的第一个适应症为原发性膜性肾病。
截至2025年3月21日的最新结果进一步支持EVER001作为潜在“同类最佳”药物的安全性及临床获益。
云顶新耀表示,预计将在2025年下半年公布EVER001包括免疫学缓解、临床缓解及安全性数据在内的为期一年的随访结果。
图片来源:云顶新耀2025年半年报
在上半年实现多个研发里程碑的同时,云顶新耀正积极优化研发策略,加快开发mRNA平台及自体生成CAR-T。
在其自主研发的mRNA技术平台中,针对个性化mRNA肿瘤疫苗EVM16的研究者发起试验(IIT)已为9名晚期或复发性实体瘤患者完成给药,初步数据预计将于今年下半年读出。
EVM14是一款靶向5个肿瘤相关抗原的通用型的现货肿瘤治疗性疫苗,拟用于鳞状非小细胞肺癌、头颈鳞癌等瘤种的治疗。目前,EVM14已获得美国食品药品监督管理局(FDA)的新药临床试验批准,云顶新耀计划于2025年下半年在美国启动EVM14的临床研究并完成首例患者入组。
此外,中国国家药品监督管理局药品审评中心也已受理EVM14的IND申请,预计将于今年下半年获得中国IND批准。云顶新耀计划在2026年初启动中国临床试验。而这也是云顶新耀首次实现产品管线中美双报。
其自体生成CAR-T项目EVM18已完成多项非人灵长类动物(猴)研究,并确定临床候选分子,预计于2025年底前启动临床试验。
通过“双轮驱动”,云顶新耀在实现单品大爆的同时也做到了后续产品的有效接力。而其预计的超250亿元未来销售峰值,也值得期待。
 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-12-17
2025-12-17
 14
14

 产业资讯
产业资讯
 智药局
智药局  2025-12-17
2025-12-17
 12
12

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-12-17
2025-12-17
 14
14