 产业资讯
产业资讯
 药时空
药时空  2025-09-02
2025-09-02
 2292
2292
2024-2025年,全球已有至少8篇重量级研究在《Lancet》《Science》《Cell》《Nature》子刊等顶刊发表,标志着体内(in vivo)CAR-T技术进入“动物验证→初步临床试验”的新阶段。有别于传统的ex vivo CAR-T疗法(嵌合抗原受体T细胞疗法),体内CAR-T技术的革命性在于,它旨在以LNP或者病毒载体为体内递送载体,直接在患者体内对T细胞进行重编程,在理想情况下,能够完全避免所有在体外的对细胞的操作。
据公开数据显示,全球已有超过20款in vivo CAR-T管线处于临床前或临床早期开发阶段,技术路线呈现多元化竞争格局。本文盘点了10款进入临床阶段的体内CAR-T在研管线,基本处于临床1期阶段,以国外企业为主。
表1:全球10款进入临床阶段的体内CAR-T在研管线
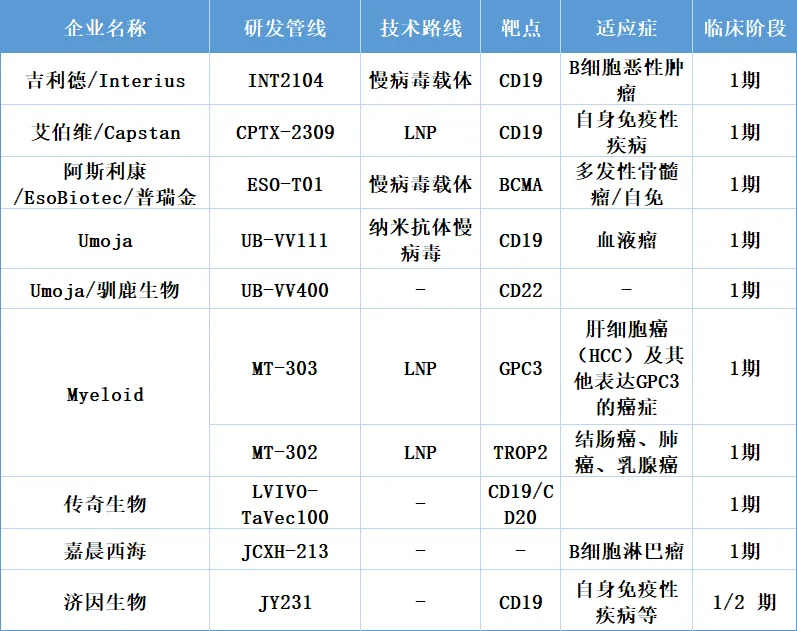
1、INT2104
INT2104是一种新型体内嵌合抗原受体(CAR) 基因疗法,旨在在患者体内产生CAR-T和 CAR-NK细胞,以靶向表达CD20的恶性B细胞。其是一种现成的单剂量治疗方法,通过静脉输注进行全身给药,无需淋巴滤除或任何特殊设施设备。
INT2104由Interius BioTherapeutics开发,Interius
BioTherapeutics是一家领先的生物技术公司,正在开发新型现成的基因疗法,利用靶向慢病毒载体技术在体内生成自体嵌合抗原受体(CAR)细胞。
2024年10月,INT2104在澳大利亚完成了首例患者给药,成为全球首个进入人体临床试验的体内CAR-T疗法。随后在2025年,该试验扩展到了欧洲,获得了德国监管机构的批准。目前,INT2104已进入I期临床试验阶段(NCT05869566),有望在未来重塑CAR疗法的开发与应用范式,拓展细胞与基因疗法的可及性与临床应用范围。
2025年8月21日,吉利德旗下的Kite宣布以3.5亿美元收购Interius BioTherapeutics。完成收购后,Interius团队将整合至Kite研发体系,并在费城设立卓越研究中心,加速推进INT2104的临床开发,计划2026年提交生物制品许可申请(BLA)。
2、CPTX-2309
CPTX2309是一种靶向脂质纳米颗粒tLNP,可将编码抗CD19 CAR的mRNA递送至体内表达 CD8+ T细胞,是治疗B细胞介导的自身免疫性疾病的潜在首创产品。该过程在体内实现,无需淋巴细胞清除预处理和复杂的体外制造。
CPTX2309由Capstan Therapeutics开发,Capstan是一家临床阶段生物技术公司,致力于利用tLNP递送RNA来推进体内细胞工程,公司核心平台CellSeeker™可用于不同的治疗领域,最初的重点是开发用于治疗B细胞介导的自身免疫性疾病的下一代体内CAR-T疗法。目前,CPTX2309处于 I 期临床试验阶段,用于治疗B细胞介导的自身免疫性疾病。
2025年6月,Capstan公司宣布 CPTX2309正式开始1期临床试验,用于治疗B细胞介导的自身免疫疾病。随后,公司及宾夕法尼亚大学的研究人员在 Science 期刊发表了题为:In vivo CAR T cell generation to treat cancer and autoimmune disease 的研究论文。当月月底,艾伯维宣布以21亿美元收购Capstan,前者将获得后者专有的tLNP平台技术和其主导资产CPTX2309。
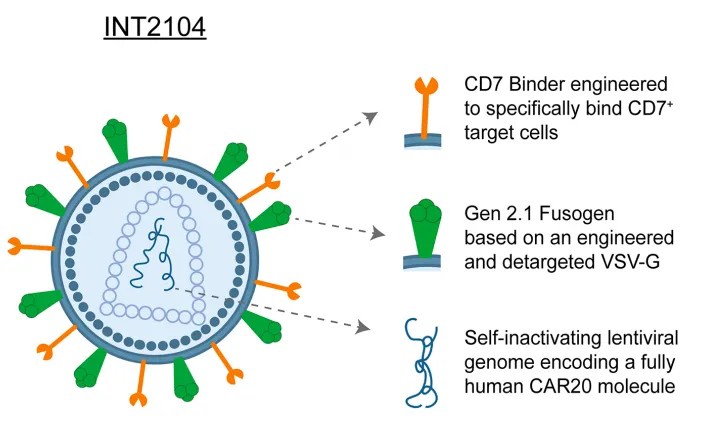
3、ESO-T01
ESO-T01是一种基于纳米抗体靶向、具备免疫屏蔽功能的慢病毒载体,用于体内T细胞工程化改造,该载体搭载的是靶向BCMA的人源化单域抗体 CAR,由 EsoBiotec和普瑞金合作开发。
EsoBiotec是一家开创体内细胞疗法的生物技术公司,其工程纳米抗体慢病毒 (ENaBL)
平台能够通过纳米抗体的识别特异性转染免疫细胞。普瑞金是一家以“为临床治疗开发急需的细胞与基因药物”为使命的国家高新技术企业,多年深耕于细胞与基因治疗药物领域,产品管线包括多个靶点的CAR-T、CAR-NK和TCR-T药物等,适应症涵盖血液系统肿瘤、实体瘤和自身免疫疾病等多个治疗领域。2025年3月17日,阿斯利康宣布收购比利时生物技术公司EsoBiotech,布局体内CAR-T等细胞疗法,阿斯利康支付4.25亿美元预付款,5.75亿美元里程碑金额,交易总金额为10亿美元。
2025年1月8日,EsoBiotec宣布与普瑞金生物合作开发的ESO-T01的IIT研究(在中国进行)完成首例患者给药,无需淋巴细胞清除,单剂量给药后,在28天骨髓中已检测不到癌细胞。7月2日,武汉同济医学院附属协和医院的梅恒教授团队、EsoBiotec团队、普瑞金团队在Lancet上共同发表了In-vivo B-cell maturation antigen CAR T-cell therapy for relapsed or refractory multiple myeloma文章,研究团队介绍了一项正在进行中的单臂、开放标签、剂量递增的1期临床试验中首批 4 例复发或难治性多发性骨髓瘤患者接受最低剂量ESO-T01 治疗的 first in human 数据,以评估该细胞疗法安全性、耐受性和初步疗效。
4、UB-VV111
UB-VV111是一款通过VivoVec平台开发的体内CAR-T细胞疗法。其包含一个表面经过工程化的病毒包膜,以及编码CD19靶向CAR和雷帕霉素激活细胞因子受体(RACRTM)的转基因,旨在于患者体内扩增UB-VV111工程化CAR-T细胞。
UB-VV111由Umoja开发,Umoja成立于2019年,致力于开发体内细胞疗法,提高肿瘤和自身免疫领域CAR-T细胞疗法的覆盖范围、有效性和可及性。
2024年1月,Umoja与艾伯维达成总计高达14.4亿美元的合作,在肿瘤学领域开发多个体内CAR-T细胞治疗候选药物。其中包括UB-VV111,开发用于治疗血液恶性肿瘤。
2024年7月31日,Umoja宣布UB-VV111 IND申请获FDA批准,用于治疗血液恶性肿瘤。该I期研究(NCT06528301)将招募复发/难治性大B细胞淋巴瘤(LBCL)和慢性淋巴细胞白血病(CLL)患者,以评估UB-VV111的安全性、耐受性和临床抗肿瘤活性。
5、UB-VV400
UB-VV400是Umoja与驯鹿生物的共同研发的产品,处于临床I期阶段,这是基于双方在2024年1月达成的合作。
2024年1月4日,驯鹿生物和Umoja Biopharma共同宣布就新型体外和体内细胞与基因疗法的研发和商业化开展一系列新的合作。根据协议,驯鹿生物将获得Umoja的雷帕霉素激活的细胞因子受体(RACR™)平台——合成细胞因子受体技术的独家使用权,用于开发两种体外的iPSC来源的嵌合抗原受体(CAR)细胞疗法。驯鹿生物将负责上述两个体外细胞治疗产品在全球范围的研发、生产、注册和商业化。同时 Umoja将独家使用驯鹿生物经临床验证的两个不同靶点的CAR序列,结合Umoja自研的慢病毒载体体内基因递送技术——VivoVec™推进两个体内CAR-T候选产品的研发;驯鹿生物与Umoja将分别负责大中华区与除大中华区以外的其他地区的产品研发、生产、注册和商业化。此外,双方有权在合作中收取相应的开发和销售里程碑付款以及特许权使用费。
6、MT-302
MT-302是首个进入临床试验的基于静脉注射mRNA的CAR疗法。它利用包裹在脂质纳米颗粒(LNP)中的合成mRNA,在体内重编程循环免疫细胞,使其表达靶向TROP2的CAR。TROP2 在许多上皮性肿瘤中过表达,而在健康组织中表达较低。
MT-302是Myeloid首个体内CAR临床项目,Myeloid Therapeutics是一家临床阶段免疫学公司,致力于开发尖端RNA技术,对免疫细胞进行编程,以对抗癌症和其他致命疾病。
据MT-302针对TROP2阳性晚期上皮癌成人患者的1期临床研究更新结果显示:在给药后数小时内,循环髓系细胞中即可检测到强效的 TROP2 CAR 表达。与基线相比,给药后的肿瘤活检样本显示抗原呈递标志物和促炎信号增加。MT-302诱导了全身性干扰素驱动的趋化因子反应,并重塑了肿瘤免疫微环境,促进效应T细胞募集。
7、MT-303
MT-303是Myeloid的另一款基于mRNA的CAR疗法,利用LNP递送直接在体内对髓系细胞进行重编程,其mRNA编码的是一种靶向GPC3的CAR受体,包含一个与CD89的跨膜结构域和细胞质尾相连的单链可变片段(scFv),能够更加精准地进行免疫激活。
临床前研究表明,MT-303能够有效浸润到肿瘤中,杀伤肿瘤细胞并产生趋化因子和细胞因子,引发适应性抗肿瘤免疫。目前,该候选产品正在开展1期临床。
8、LVIVO-TaVec100
公开资料显示,传奇生物体内CAR-T项目LVIVO-TaVec100,是一种靶向CD19/CD20的双特异性体内CAR-T生成制剂,目前已于2025年5月启动I期申办者发起的试验,首批初步临床结果有望在2025年底公布。
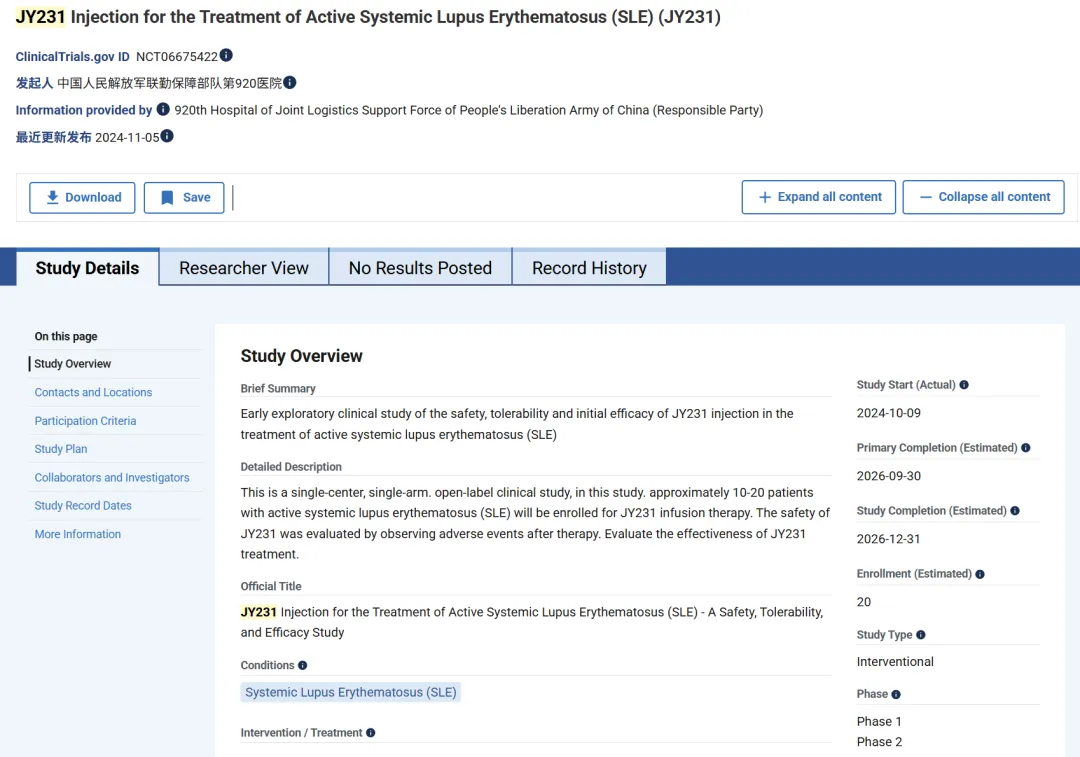
9、JY231
2024年10月,济因生物宣布其CD19靶向的体内CAR-T细胞疗法的IIT研究进展:一例高肿瘤负荷的复发难治弥漫性大B细胞淋巴瘤(B-NHL 的一种)在接受体内CAR-T细胞疗法治疗 1 个月后,获得完全缓解(CR)并出院,且未出现2级以上细胞因子释放综合征(CRS)或神经毒性(ICANS)等 CAR-T 治疗常见副作用。同时,其又宣布了另一项IIT研究进展,接受靶向 CD19体内CAR-T 细胞疗法治疗的一名复发难治急性B淋巴细胞白血病(B-ALL)患者也实现了CR并顺利出院。
另外,据clinicaltrials.gov网站显示,有一项关于JY231注射治疗活动性系统性红斑狼疮(SLE)(JY231)的临床试验,这是一个单中心、单臂、开放标签临床研究,在该研究中,大约 10-20 名活动性系统性红斑狼疮(SLE)患者将被纳入JY231输液治疗,通过观察治疗后的不良事件来评估JY231的安全性和有效性。该试验处于临床1期/2期阶段。
10、JCXH-213
JCXH-213是一款嘉晨西海开发的具有自主知识产权的体内CAR(in vivo CAR)药物。和现行的传统CAR-T疗法不同,JCXH-213不需要收集患者或供者细胞进行体外CAR-T制备,而是基于先进的mRNA技术,通过嘉晨西海自主开发的靶向纳米脂质体(targeted Lipid Complex Nano Particles, tLCNP)将表达CAR分子的信使核糖核酸直接递送至患者体内的多种免疫细胞,产生强效肿瘤杀伤性CAR-T、CAR-M和CAR-NK,以组合协同的方式起到清除肿瘤的效果。
2025年3月,JCXH-213完成I 期临床首例给药,此项试验是世界范围内基于信使RNA-纳米脂质颗粒的in vivo CAR首次应用于人体研究。

 产业资讯
产业资讯
 新康界
新康界  2026-01-28
2026-01-28
 33
33

 产业资讯
产业资讯
 氨基观察
氨基观察  2026-01-28
2026-01-28
 31
31

 产业资讯
产业资讯
 动脉网
动脉网  2026-01-28
2026-01-28
 32
32