 会员动态
会员动态
 Medaverse
Medaverse  2025-09-03
2025-09-03
 816
816

9月1日,恒瑞医药宣布HRS9531注射液的上市申请已获国家药监局受理,本次申请的适应症为:在控制饮食和增加运动基础上,初始体重指数(BMI)符合以下要求的成人的长期体重管理:≥28kg/m2(肥胖),或≥24 kg/m2(超重)并伴有至少一种体重相关合并症(例如高血糖、高血压、血脂异常、阻塞性睡眠呼吸暂停、脂肪肝等)。此外恒瑞还在开发每日一次的HRS9531口服片剂、口服小分子GLP-1抑制剂HRS-7535、GLP-1/GIP/GCG激动剂,用于治疗肥胖。

HRS9531是恒瑞医药自主研发的胰高血糖素样肽‑1(GLP-1)和葡萄糖依赖性促胰岛素肽(GIP)双重受体激动剂,拟开发用于超重/肥胖及相关合并症、以及2型糖尿病等适应症的治疗。迄今为止,HRS9531已开展多项临床试验,超过2000名中国受试者接受了HRS9531治疗。
今年7月HRS9531注射液治疗中国肥胖或超重受试者的III期临床研究(HRS9531-301)获得积极顶线结果。与安慰剂相比,HRS9531所有剂量组(2mg、4mg、6mg)在共同主要终点及全部关键次要终点上均达到优效性。该研究是在肥胖或超重受试者中评估HRS9531注射液的有效性和安全性的多中心、随机、双盲、安慰剂平行对照的III期临床研究,由复旦大学附属中山医院李小英教授担任主要研究者,研究共入组567例肥胖或超重合并至少一种体重相关合并症的成人患者。研究结果表明,试验组在主要疗效终点和所有关键次要疗效终点上显著优于安慰剂组,HRS9531高剂量组平均体重降低达19.2%,44.4%的受试者体重降低≥20%,且安全性和耐受性良好。

具体而言,该研究共入组567名肥胖或超重受试者,平均基线体重为93公斤。主要分析(疗法策略)结果表明,HRS9531注射液治疗48周后,平均体重降低最高达17.7%(安慰剂调整后为16.3%),体重降低≥5%的受试者比例达88.0%。此外,高剂量组44.4%的受试者体重降低≥20%。
HRS9531显示出良好的安全性和耐受性,与其他GLP-1药物治疗和HRS9531先前报道的II期临床数据一致。大多数治疗期间出现的不良事件(TEAEs)为轻度至中度,主要为胃肠道相关事件。
在既往报道的II期临床试验结果(NCT06054698)中,主要分析(疗法策略)结果表明,HRS9531注射液8mg治疗36周后平均体重降低22.8%(安慰剂调整后为21.1%),且没有到达平台期,同时具有良好的安全性。补充分析(假想策略)结果显示,HRS9531注射液8mg平均体重减轻达23.6%(安慰剂调整后为21.7%)。
HRS9531注射液减重III期临床试验的完整结果将在即将举行的学术会议上公布。
HRS9531注射液可在体内调节糖脂代谢、抑制食欲和增强胰岛素敏感性,从而起到改善血糖和减轻体重的效果。目前全球范围内针对减重适应症,仅有礼来的同靶点药物替尔泊肽注射液(商品名:ZEPBOUND)于2023年11月在美国获批上市, 并于2024年7月在国内(商品名:穆峰达)获批上市。2024年ZEPBOUND全球销售额合计约为49.26亿美元,加上降糖版替尔泊肽(Mounjaro)的115.4亿美元,替尔泊肽制剂在2024年给礼来制药贡献165亿美元。截至目前,HRS9531相关项目累计研发投入约45,235万元。

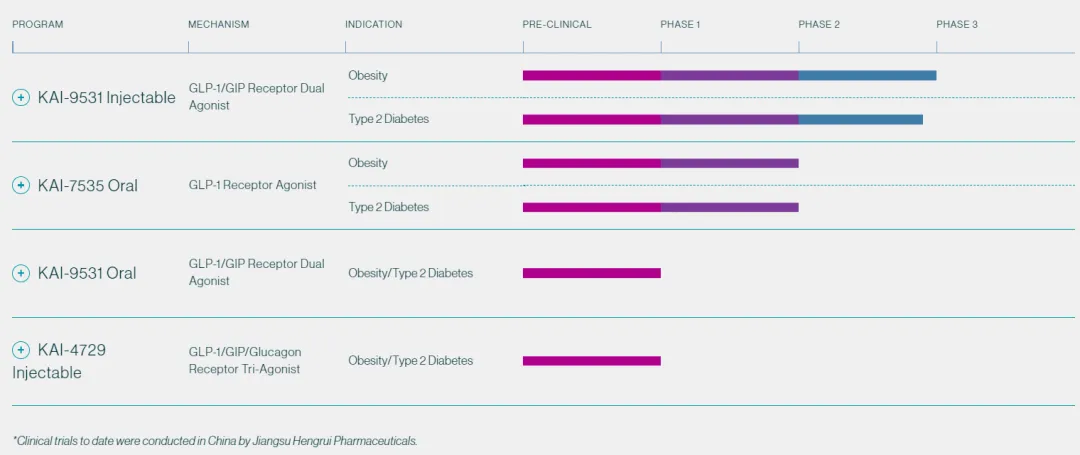
2024年5月,HRS9531作为恒瑞医药具有自主知识产权的GLP-1类创新药组合之一,除大中华区以外的全球范围内开发、生产和商业化的独家权利被公司有偿许可给美国Kailera
Therapeutics。首付款加里程碑付款累计可高达60亿美元,公司还取得Kailera19.9%的股权。Kailera正在全球(大中华区除外)推进HRS9531的临床开发,代号为KAI-9531。(新锐!4亿美元A轮融资,恒瑞GLP-1资产海外NewCo正式官宣)

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 164
164

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 163
163

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 183
183