 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-09-05
2025-09-05
 1325
1325
2022年8月,60多年来全球首个采用新机制的抗抑郁口服药Auvelity(氢溴酸右美沙芬和盐酸安非他酮复方缓释片)在美国获批上市,打破了抗抑郁老药市场格局。
2023年8月,首个也是唯一一个用于成人产后抑郁症(PPD)口服治疗药物Zurzuvae(Zuranolone)在美国获批上市,拓宽了抑郁症治疗患者人群。
2025年1月,强生宣布以总交易额约为146亿美元收购Intra-Cellular Therapies,该公司核心产品为5-羟色胺2A(5-HT2A)受体拮抗剂和多巴胺受体D2调节剂Caplyta(卢美哌隆,Lumateperone),Caplyta已获FDA批准用于治疗成人精神分裂症,以及与双相I型或II型障碍相关的抑郁发作。
2025年8月,艾伯维以高达12亿美元的价格收购Gilgamesh Pharmaceuticals旗下的抗抑郁药物bretisilocin,该药物目前处于临床2期。
这些新机制药物获批和重磅交易显示了制药行业对抑郁症治疗领域的重视和投入,也反映了市场对新型、更有效抑郁症药物的迫切需求。
01
抑郁症流行病学
抑郁症是一种常见的精神障碍,主要表现为情绪低落、兴趣减退、思维迟缓和身体不适等症状。它不仅影响患者的生活质量,还可能对工作、学习和社交功能产生负面影响。
根据2021年全球疾病负担研究,全球抑郁症发病数为3.5744亿例,患病数为3.3241亿例,伤残调整生命年(DALYs)为5633万。抑郁症在全球范围内都是一个重大的公共卫生挑战,其发病率、患病率和DALYs的年龄标准化率虽有下降趋势,但绝对病例数和年龄标准化率仍在增加[1]。
重度抑郁症是美国最常见的精神障碍之一。对于某些人来说,重度抑郁症会导致严重的损伤,干扰或限制一个人进行主要生活活动的能力。
2021年,美国估计有2100万成人至少经历过一次重度抑郁发作,占所有美国成人的8.3%。其中,女性的发病率为10.3%,高于男性的6.2%,18-25岁年龄段的发病率为18.6%,是所有年龄段中最高的,在有多种(两个或以上)种族身份的人群中,重度抑郁发作的发病率最高,为13.9%(图1)[2]。
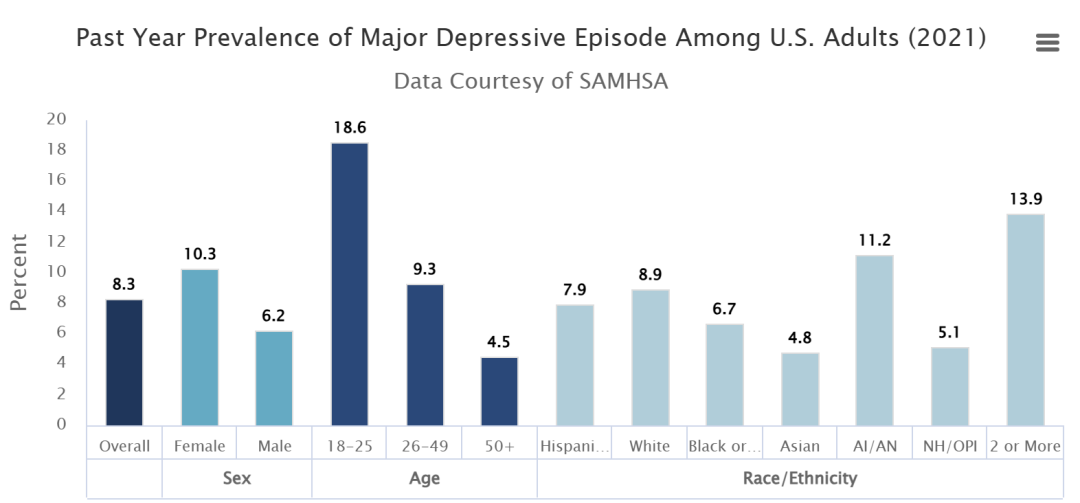
图1. 2021年美国18岁或以上成年人过去一年重度抑郁发作的患病率
据估计,美国有500万12至17岁的青少年至少有一次重度抑郁发作。这一数字占美国12至17岁人口的20.1%。
与男性(11.5%)相比,青春期女性(29.2%)的重度抑郁发作患病率更高。
重度抑郁发作的患病率在两个或两个以上种族的青少年中最高(27.2%)。
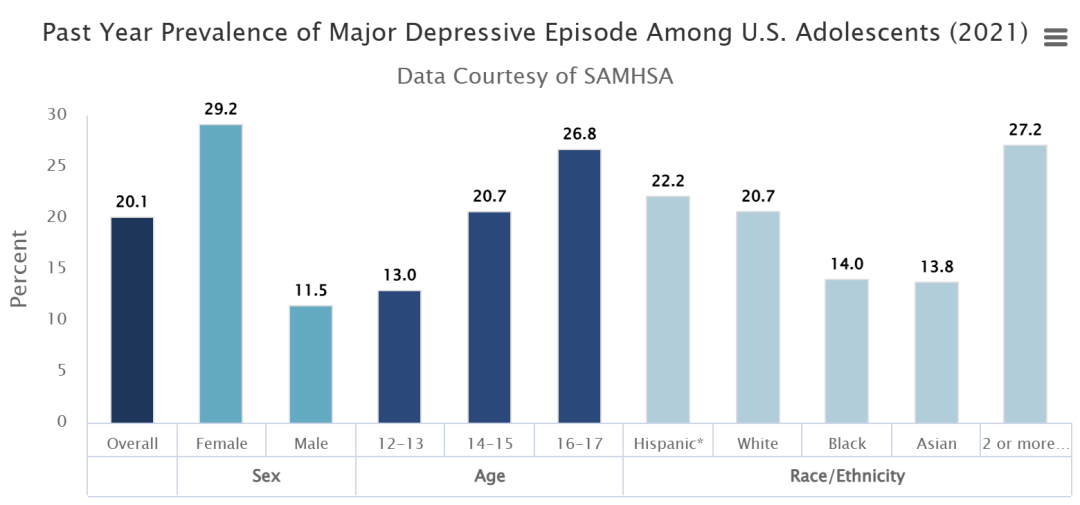
图2. 2021 年美国青少年重度抑郁发作的过去一年患病率
根据中国精神卫生调查(CMHS)的数据,中国抑郁症的终生患病率为6.8%,12个月患病率为3.6%。这意味着超过9500万中国人一生中曾患过抑郁症。女性抑郁症的终生患病率为8.0%,显著高于男性的5.7%[3]。
02
抑郁症发病机制
到目前为止,抑郁症的发病机制吸引了世界各地越来越多的研究人员进行探索,但确切的发病机制仍不清楚。受体假说已被用于从多个角度阐明抑郁症的发病机制[1]。
除了众所周知的受体,如NMDA受体、AMPA受体、糖皮质激素受体、5-HT受体、GABA受体和DA受体外,“非经典”受体,如代谢型谷氨酸受体、阿片受体和胰岛素受体,对抑郁症的发病机制也很重要(图1)。
此外,大量研究表明,抑郁症的发生和发展与遗传基础密切相关,遗传基础占抑郁症风险的近 40-50%,导致抑郁症成为一种高度遗传的疾病,并受到更广泛的关注。
由于抑郁症(MDD)的发病机制复杂,准确的诊断方法和药物治疗策略相对有限。为了解释抑郁症的发病机制,提出了几种假说,包括:(i)下丘脑-垂体-肾上腺(HPA)轴功能障碍假说,(ii)单胺假说,(iii)炎症假说,(iv)遗传和表观遗传异常假说,(v)大脑结构和功能重塑假说,以及(vi)社会心理假说(图3)[4]。
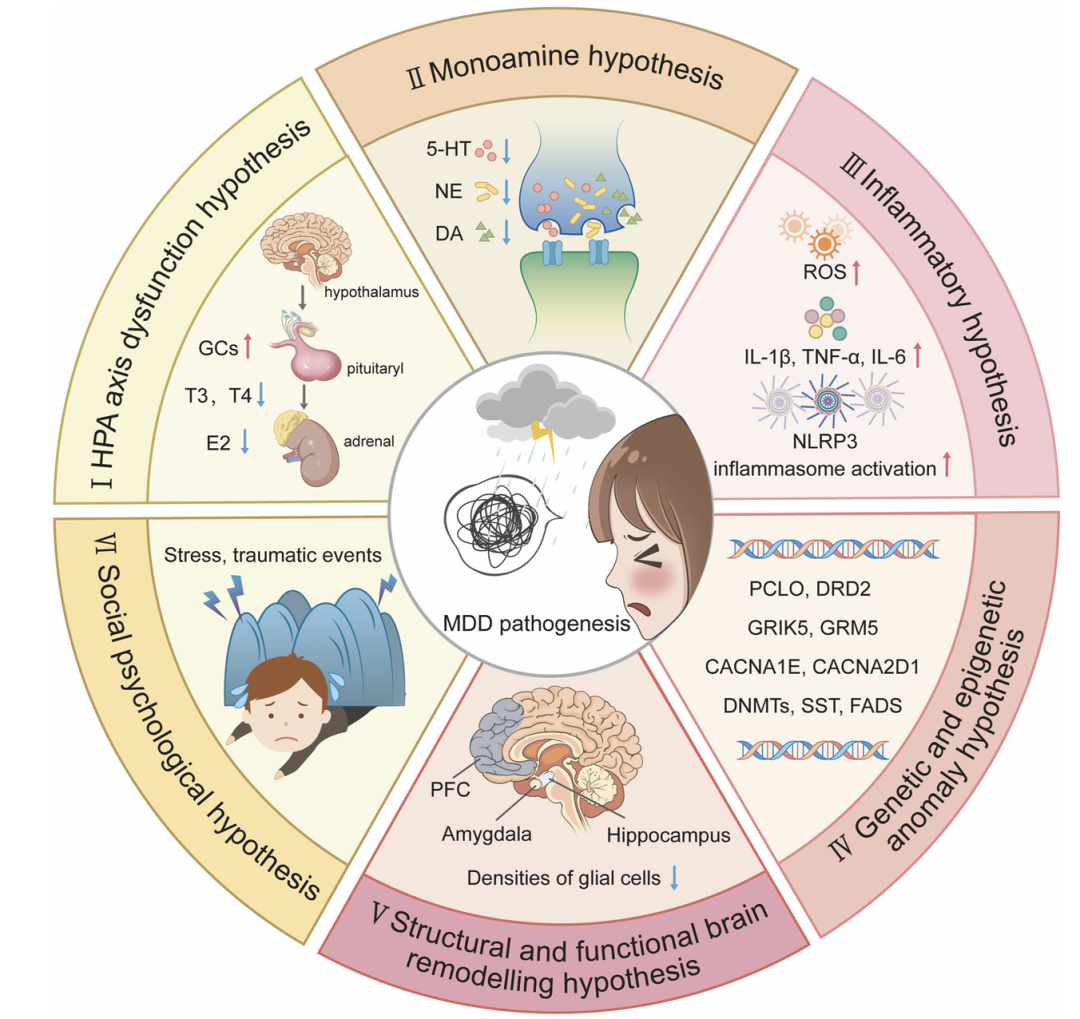
图3. 抑郁症发病机制
HPA轴功能障碍假说认为,抑郁症的发生与HPA轴的过度激活和负反馈机制受损密切相关。这种功能障碍导致GC水平异常升高,进而影响神经递质和神经营养因子的活性,最终导致抑郁症的发生。
单胺假说是解释抑郁症发病机制的经典理论之一,单胺假说认为,抑郁症的发生与大脑中单胺类神经递质的缺乏有关,主要包括5-羟色胺(5-HT,血清素)去甲肾上腺素(NE)、多巴胺(DA)等神经递质。
许多抗抑郁药物的作用机制都是通过增加大脑中单胺类神经递质的水平来发挥作用。例如,选择性5-羟色胺再摄取抑制剂(SSRIs)通过抑制5-HT的再摄取,增加突触间隙中5-HT的浓度,从而改善抑郁症状。三环类抗抑郁药(TCAs)则同时抑制5-HT和NE的再摄取。这些药物的疗效支持了单胺假说。
然而,没有任何一种假说能够单独充分解释抑郁症(MDD)的病理基础,而这些假说所提出的许多机制相互之间存在交互作用。近年来,在识别抑郁症的新药物疗法、诊断标准以及非药物预防措施方面取得了巨大进展,并启动了相关的临床试验。具体而言,越来越多的证据表明,星形胶质细胞功能障碍在抑郁症中起着重要作用。在实验动物中,通过药物消融内侧前额叶皮质(mPFC)中的星形胶质细胞会导致抑郁样症状,而且对抑郁症患者的尸检研究显示,其前额叶皮质(PFC)、海马和杏仁核中胶质细胞的密度降低。
03
获批的抑郁症药物
全球已有多款药物上市,不过目前世界各地抗抑郁症治疗相关指南中推荐的药物治疗方案一致性差,美国常用的12种抗抑郁药包括了选择性5-羟色胺再摄取抑制剂(SSRIs)、5-羟色胺和去甲肾上腺素再摄取抑制剂(SNRIs)以及非典型抗抑郁药。
这些药物分别是:舍曲林(左洛复)、艾司西酞普兰(来士普)、曲唑酮、氟西汀(百忧解)、安非他酮(安非他酮)、度洛西汀(欣百达)、喹硫平(思瑞康)、西酞普兰(喜普妙)、文拉法辛(怡诺思)、阿立哌唑(安律凡)、帕罗西汀(帕罗西汀)和米氮平(瑞美隆)。这些药物常被用于治疗重度抑郁症及相关疾病,因为它们疗效显著且副作用各有不同,使临床医生能够根据患者个体需求调整治疗方案[5]。
全球常用的抗抑郁症药物有灵北的艾司西酞普兰、辉瑞的舍曲林、艾伯维的氟伏沙明、GSK的帕罗西汀、礼来的度洛西汀和惠氏的文拉法辛等。
近几年,也有一些新颖机制的抗抑郁药物获批上市。
2019年3月,艾司氯胺酮鼻喷雾剂首次获得美国FDA批准,用于治疗难治性抑郁症(TRD),需与口服抗抑郁药联合使用。
艾司氯胺酮(Esketamine)是氯胺酮的右旋异构体,具有更高的效价,通过阻断NMDA受体,增加谷氨酸的释放,激活AMPA受体,促进神经营养因子(如BDNF)的产生,从而增强突触可塑性和神经再生(图4)[6]。
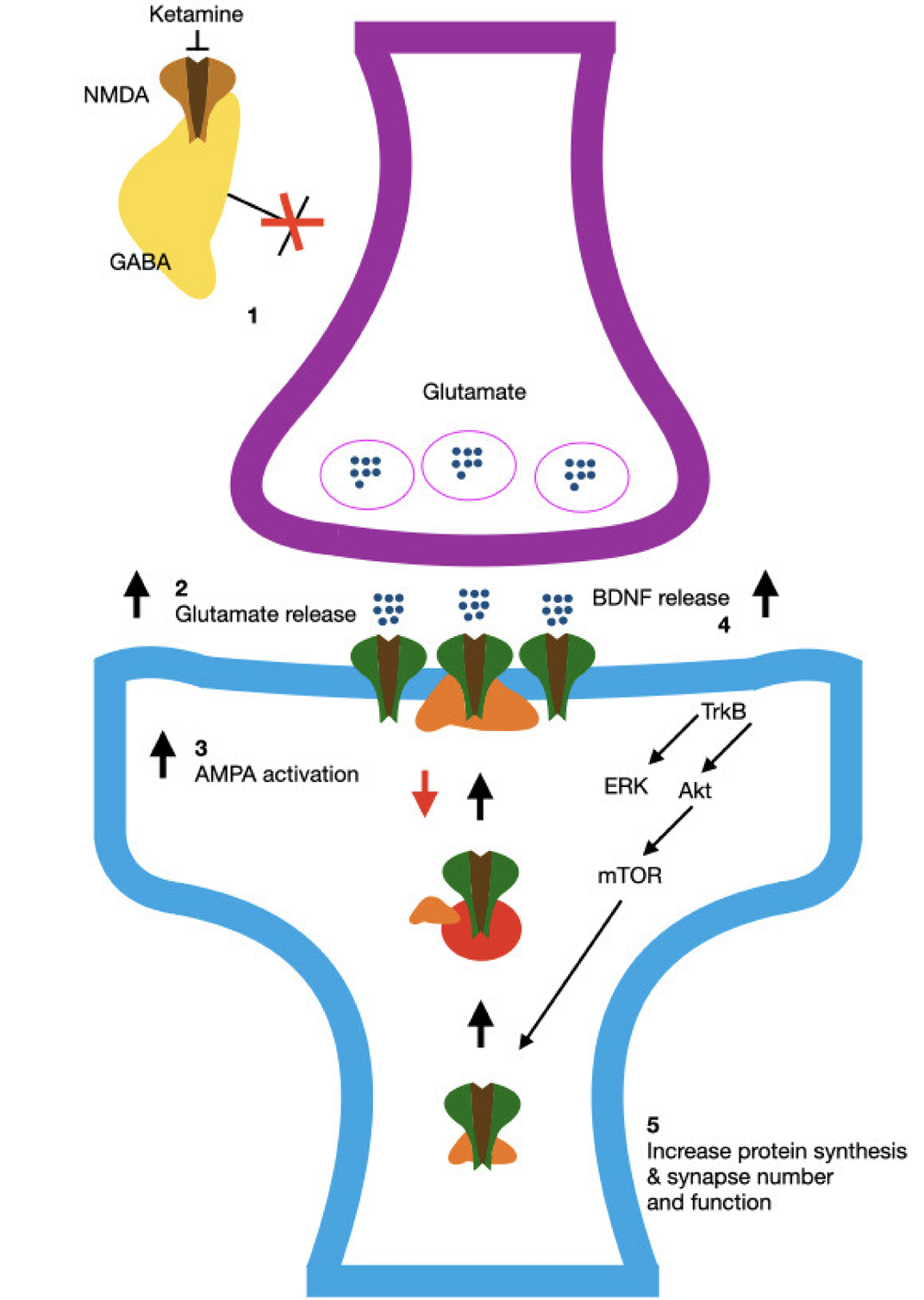
图4. 艾司氯胺酮作用机制
艾司氯胺酮的SUSTAIN-3试验结果显示:在诱导治疗期间,蒙哥马利-阿斯伯格抑郁量表(MADRS)总分有所下降,且这种下降在优化/维持治疗期间得以维持(各阶段基线至阶段终点的平均[标准差]变化:诱导期:-12.8[9.73];优化/维持期:+0.2[9.93])。在诱导治疗终点时,有35.6%的参与者达到缓解;在第112周和优化/维持治疗终点时,分别有48.5%和49.6%的参与者达到缓解(图5)[7]。
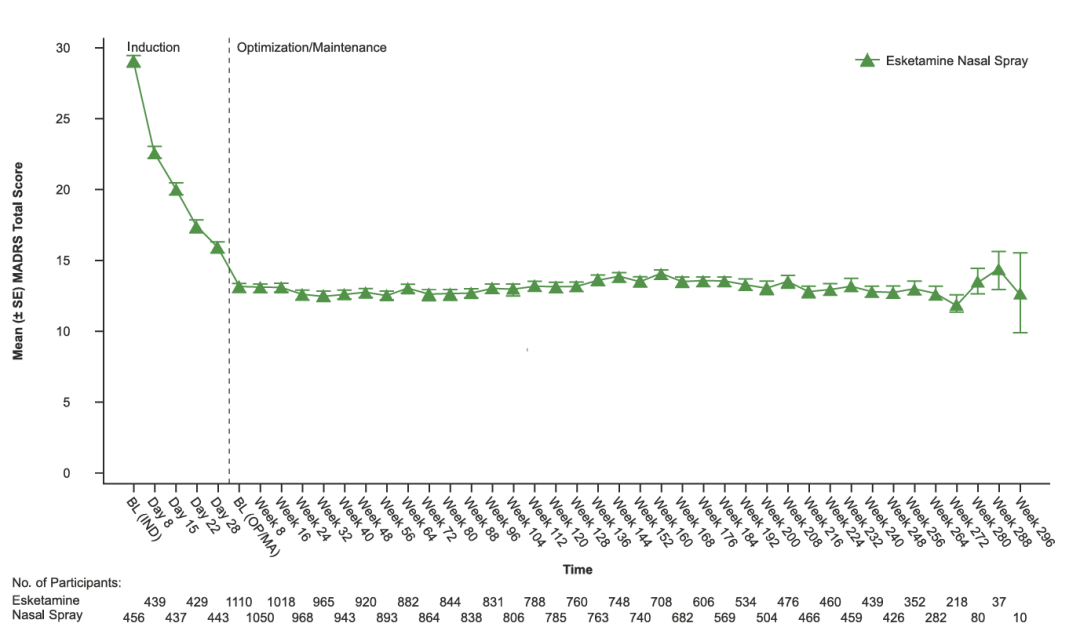
图5. 艾司氯胺酮的SUSTAIN-3试验结果
2023年4月20日,中国国家药品监督管理局正式批准了强生公司生产的盐酸艾司氯胺酮鼻喷雾剂(商品名:速开朗)在中国上市。这是中国首个获批的具有全新作用机制和给药方式的抗抑郁药物,主要用于与口服抗抑郁药联合使用,能够快速缓解伴有急性自杀意念或行为的成人抑郁症患者的抑郁症状。
2025年1月21日,强生宣布FDA批准了SPRAVATO®(Esketamine)CIII 鼻喷雾剂的补充新药申请(sNDA),使这种创新疗法成为第一个也是唯一一个针对对至少两种口服抗抑郁药反应不足的重度抑郁症(MDD)成年人的单一疗法。
2022年8月,美国生物医药公司Axsome Therapeutics的抗抑郁口服药Auvelity获得美国FDA批准,用于治疗成年人抑郁症(MDD),成为60多年来全球首个采用新机制的抗抑郁口服药,在拥挤的抗抑郁老药市场中开辟了一个新市场。
Auvelity是一种固定剂量的复方缓释片,主要成分包括氢溴酸右美沙芬(45mg)和盐酸安非他酮(105mg),右美沙芬作为NMDA受体拮抗剂和σ-1受体激动剂,调节谷氨酸能神经传递,具有抗惊厥和神经保护作用,还能阻断血清素和多巴胺的再摄取;安非他酮抑制CYP2D6酶,延长右美沙芬的半衰期,从而增强其效果(图6)。

图6. Auvelity作用机制
临床试验数据显示,Auvelity治疗成人MDD患者起效迅速,治疗1周即可显著改善抑郁症状。治疗2周后,临床治愈率较安慰剂有显著提高,且持续至治疗结束。安全性结果显示Auvelity耐受性良好(图7)。
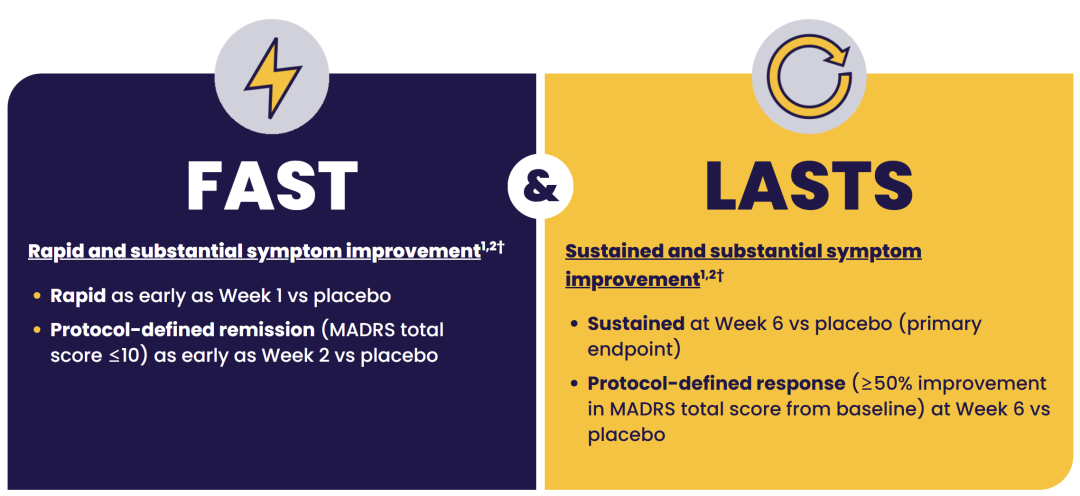
图7. Auvelity的疗效
2023年8月4日,渤健和Sage Therapeutics公司共同开发的神经活性类固醇γ-氨基丁酸A型(GABAA)受体阳性别构调节剂Zurzuvae(Zuranolone)获FDA批准,成为首个也是唯一一个用于成人产后抑郁症(PPD)口服治疗药物。2025年7月24日,欧洲药品管理局(EMA)的人用药品委员会(CHMP)也推荐授予Zurzuvae上市许可。
Zurzuvae的一项临床试验(NCT04442503)研究发现,每天服用 Zurzuvae 50 mg,持续2周的女性在第15天的抑郁症状显着减轻。
与安慰剂评分相比,Zurzuvae 50mg的17项汉密尔顿抑郁量表(HAMD-17)降低了-15.6(HAMD-17),安慰剂评分降低了-11.6,差异为-4.0,抑郁症状从第 3天开始改善,一直持续到第42天(图8)[8]。
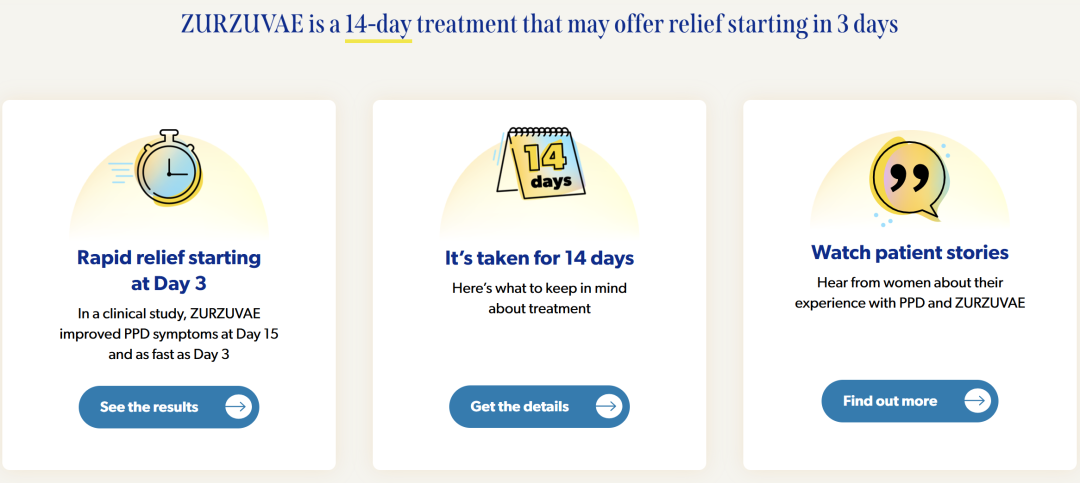
图8. Zurzuvae的疗效
04
在研的新机制抗抑郁药物
除此之外,还有很多在研的新机制抗抑郁药物,如Osavampator、Seltorexant、GH-001、NBI-1070770和JJH201501等(图9)。

图9. 部分获批和在研的抗抑郁症药物
代表性药物
1.Osavampator
Osavampator(NBI-1065845或者TAK-653)最初是由武田制药研发的一种AMPA受体正变构调节剂(PAM)。2020年,Neurocrine Biosciences获得了osavampator及其他六个神经精神疾病项目的独家授权,支付了1.2亿美元的首付款。根据最初的协议,武田制药有资格获得高达4.95亿美元的开发里程碑付款、高达14亿美元的商业里程碑付款,以及最高达到两位数比例的净销售额分成。2025年1月27日,武田重新谈判了这笔交易,重新获得osavampator在日本的独家权益(图10)[9]。
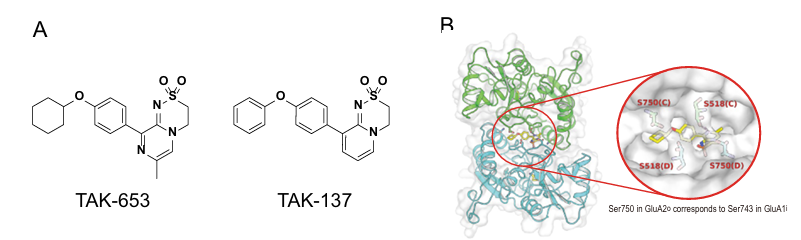
图10. Osavampator的结构
临床前研究显示:Osavampator在大鼠强迫游泳行为模型(RSBM)中,经过6天的给药后,产生了显著的抗抑郁样效应。然而,与氯胺酮不同的是,TAK-653并未在大鼠中诱导出过度运动行为,而这种行为是与人类精神分裂样副作用相关的行为指标。因此,TAK-653可能是一种具有改善安全性潜力的药物,可用于治疗包括难治性抑郁症(TRD)在内的重度抑郁症(图11)[10]。
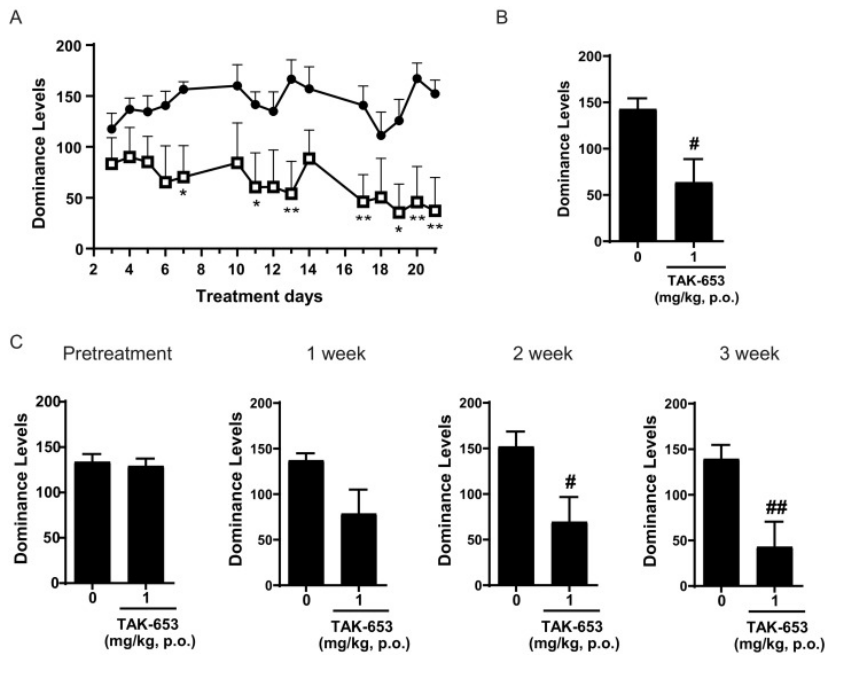
图11. Osavampator临床前研究结果
2024年4月,Neurocrine公布了osavampator在成年MDD受试者中的2期SAVITRI™研究的积极顶线数据:接受osavampator治疗的患者在第28天(主要终点)和第56天(次要终点)的蒙哥马利-阿斯伯格抑郁评分量表(MADRS)总分上均显示出统计学上显著的改善(图12)。
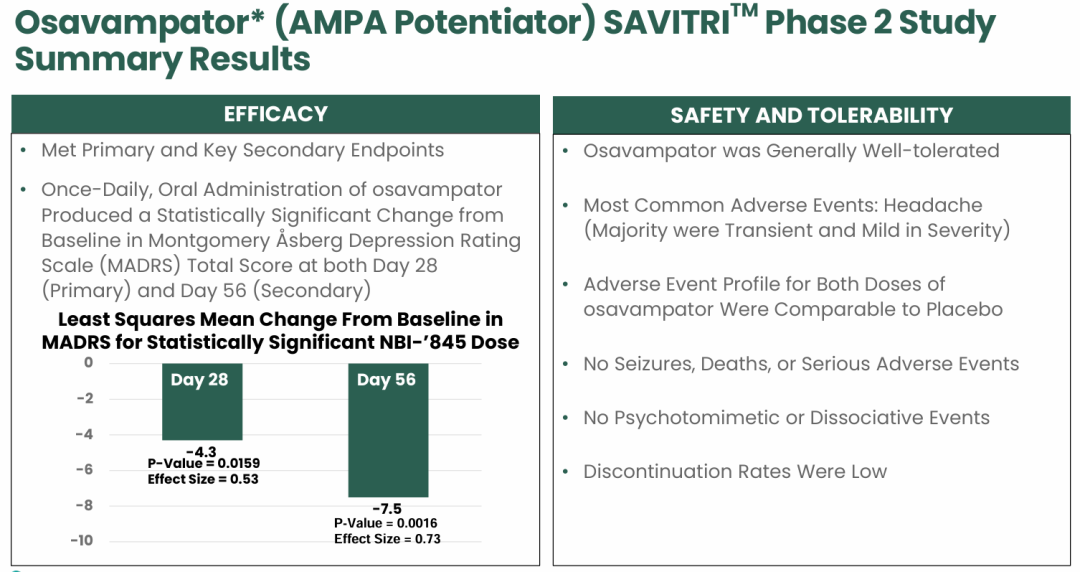
图12. Osavampator的临床结果
今年1月28日,Neurocrine宣布启动一项3期注册研究,以评估 osavampator的疗效、安全性和耐受性,用于重度抑郁症(MDD)抗抑郁药的辅助治疗[11]。
2.Seltorexant
Seltorexant 是强生公司旗下杨森制药开发的一种选择性食欲素-2受体(OX2R)拮抗剂,旨在治疗伴有失眠症状的重度抑郁症(MDD)和阿尔茨海默病等神经科学领域疾病。目前强生已终止seltorexant治疗阿尔茨海默病的临床研究,但是seltorexant在治疗伴有失眠症状的重度抑郁症显示积极效果,仍在进行中。
2024年,Mesens等人在《Molecular Psychiatry》杂志上报道了Seltorexant的一项临床1b期试验(NCT03374475)结果:共有128名参与者入组,包括86名富集样本(安慰剂导入期无反应者)(图13)[12]。
在第5周时,汉密尔顿抑郁量表17项(HDRS17)评分从基线的平均变化(标准差)在各组之间存在显著差异:Seltorexant 20mg组为-7.0(5.04),Seltorexant 40mg组为-5.5(4.34),安慰剂组为-4.4(3.67)(p=0.0456),这一差异归因于20mg组与安慰剂组之间的差异(p=0.0049)。
在基线失眠症状较严重的患者中,Seltorexant 20mg在第5周时对抑郁严重程度的改善更为显著(名义p=0.0059)。当通过去除睡眠项目来调整HDRS评分时,20mg组的治疗益处仍然显著(名义p=0.0289)。与安慰剂组相比,20mg组的HDRS17评分变化在数值上大于40mg组,这与之前的研究数据一致,在之前的研究中,Seltorexant是作为传统抗抑郁药物的辅助药物给药的。
在次要分析中,20mg组的皮质醇觉醒反应有所下降,而40mg组或安慰剂组则没有这种变化;尽管40mg组的总睡眠时间增加更多,但该组也显示出快速眼动睡眠潜伏期缩短和N1期睡眠增加,而在20mg组中则没有这种现象。这些生物标志物数据提出了可能解释Seltorexant表观曲线剂量反应关系的机制假设。
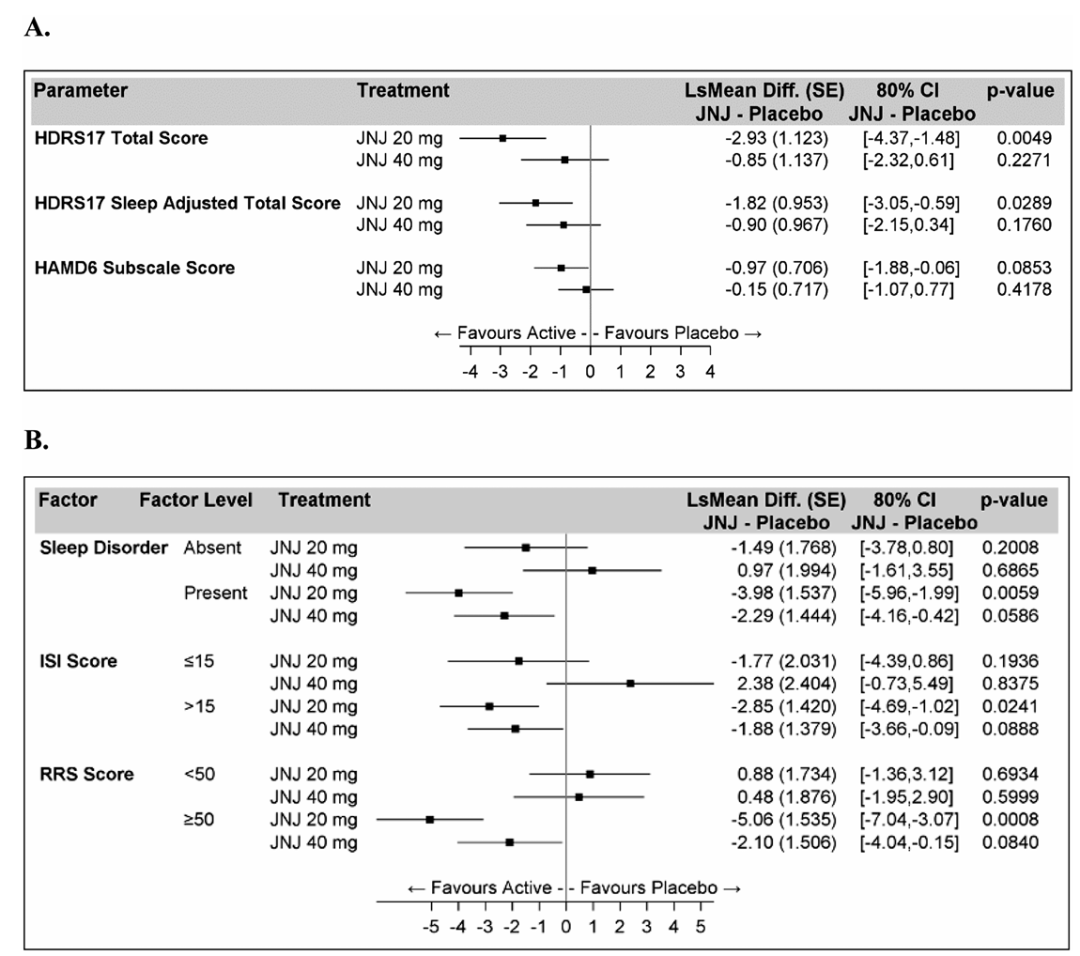
图13. Seltorexant的临床1b期试验结果
2024年5月,强生宣布seltorexant在一项针对伴有失眠症状的重度抑郁症患者的III期临床试验(MDD3001)中达到了所有主要和次要终点。该研究显示,seltorexant在改善抑郁症状和减少睡眠障碍方面具有统计学意义和临床意义(图14)[13]。
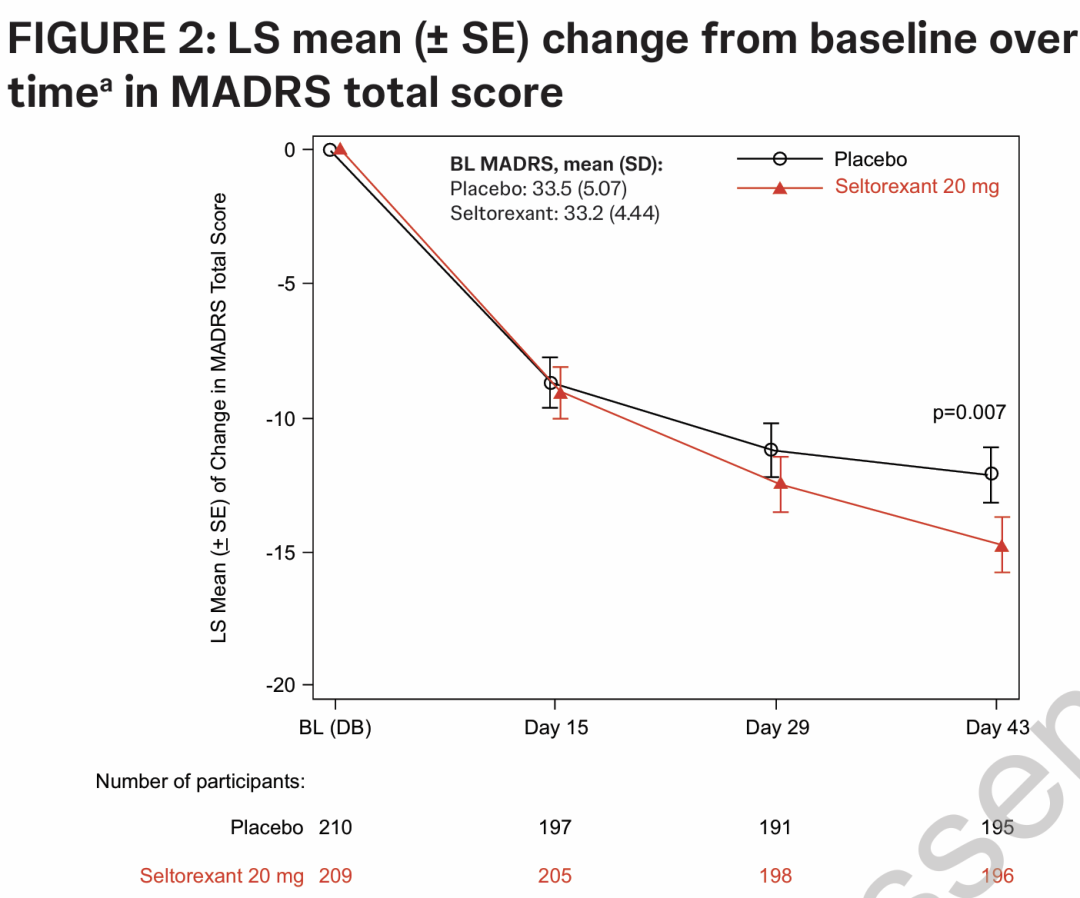
图14. Seltorexant的临床3期试验结果
3.GH001
GH001是由GH Research PLC开发的一种用于治疗难治性抑郁症(TRD)的药物。其主要成分是美布福汀(mefenamic acid,5-MeO-DMT),通过专有的吸入方式给药。GH001的开发旨在通过激活5-羟色胺2A受体(5-HT2A)来产生抗抑郁效果(图15)。
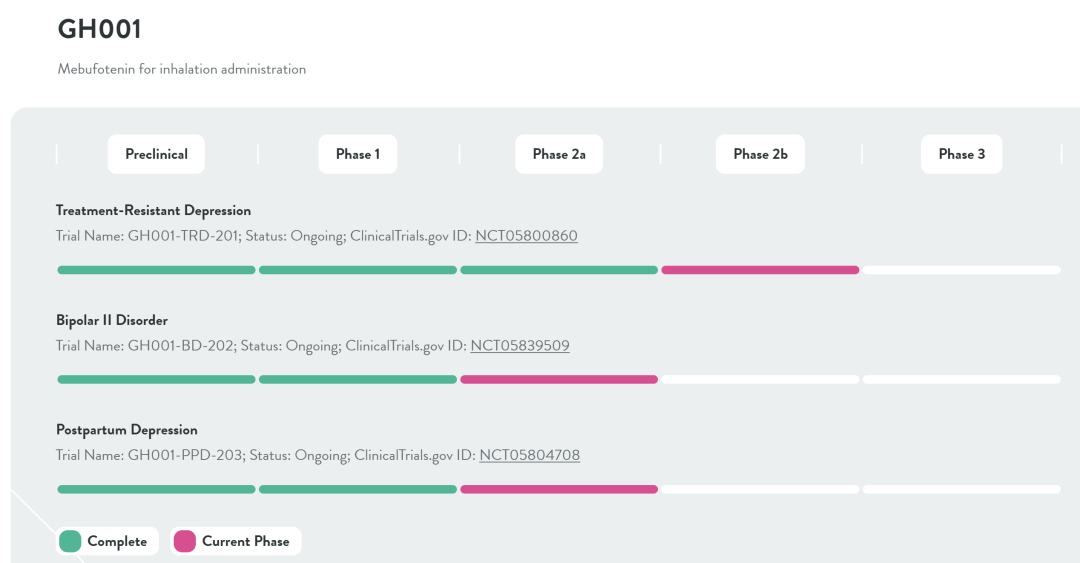
图15. GH001临床试验进展
2025年2月,GH Research宣布GH001的一项用于难治性抑郁症(TRD)患者的随机、双盲、安慰剂对照2b期临床试验(GH001-TRD-201)达到了主要终点:GH001在第8天使蒙哥马利-阿斯伯格抑郁量表(MADRS)总分从基线显著降低15.2分,而安慰剂组增加了0.3分(差异为-15.5分,p<0.0001)。
试验中的所有次要终点均达到,结果与主要终点一致。与安慰剂相比,GH001治疗在第8天使临床医生总体印象严重程度量表(CGI-S)和汉密尔顿焦虑量表(HAM-A)的评分以及生活质量问卷(Q-LES-Q-SF)的评分均显著改善,具有临床意义和统计学意义[14]。
2025年7月,GH Research宣布向FDA提交了对之前宣布的 GH001 研究性新药申请(IND)临床搁置的完整答复。他们现在已经收到了 FDA 的回复,只剩下一个保留问题。FDA要求他们提供与之前公布的大鼠呼吸道组织学结果相关的额外数据或进一步的理由。他们坚信,基于科学证据,呼吸道组织学结果是大鼠特异性的。没有与狗毒理学相关的其他请求。没有与设备相关的问题。与 FDA 就 IND 完全缓解的接触正在进行中。他们正在积极努力解决剩余的问题。
GH Research计划在2026年启动GH001的全球关键性计划,目前正在进行准备工作,包括成立指导委员会以及选择临床研究组织和研究地点。
4.Bretisilocin
Bretisilocin是由生物技术公司Gilgamesh Pharmaceuticals研发的一款5-HT2A受体激动剂和5-HT释放剂,通过作用于5-HT2A受体来发挥疗效,2025年8月,艾伯维公司以12亿美元收购了该药物(图16)。
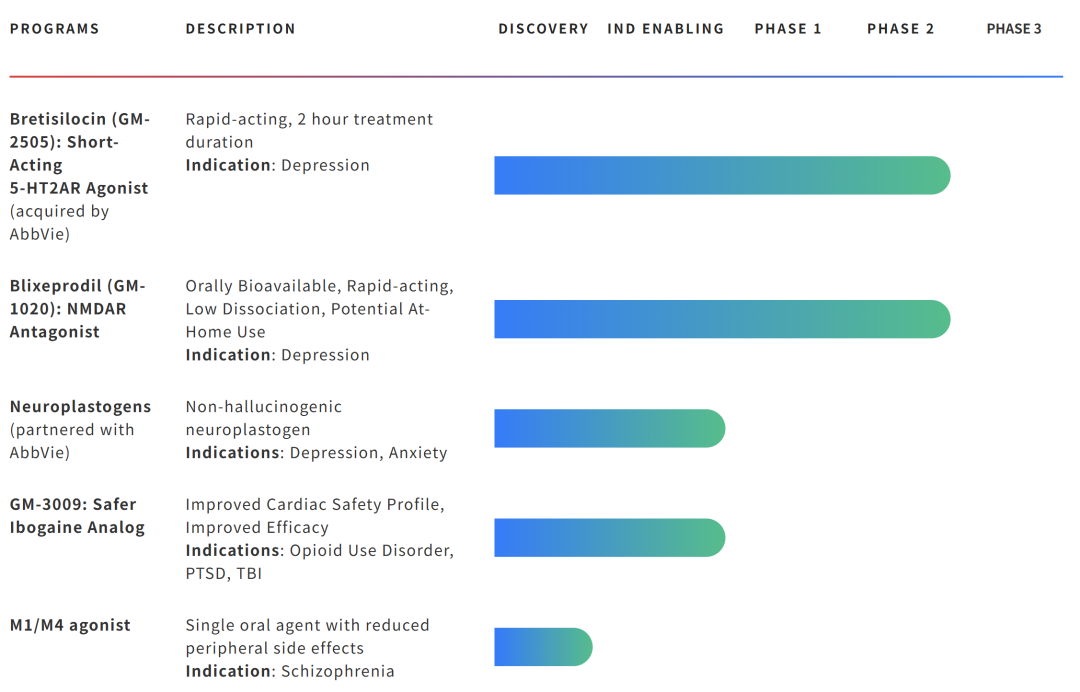
图16. Gilgamesh Pharmaceuticals的研发管线
与传统迷幻药物(如LSD和psilocybin)相比,Bretisilocin具有更短的半衰期,仅需约两小时即可完成治疗,且不引发幻觉。
2025年5月27日,Gilgamesh宣布了Bretisilocin的一项针对重度抑郁症患者 2a 期结果:接受两次药物治疗的患者中,94%在一个月后症状得到了显著缓解。在另一项2a期研究中,与低剂量对照组相比,蒙哥马利-奥斯伯格抑郁量表(MADRS)总分改善具有统计学显著性。第14天时,单剂量(10mg)治疗组MADRS总分较基线改变-21.6分,而低剂量(1mg)对照组改变-12.1分(p=0.003)(图17)。
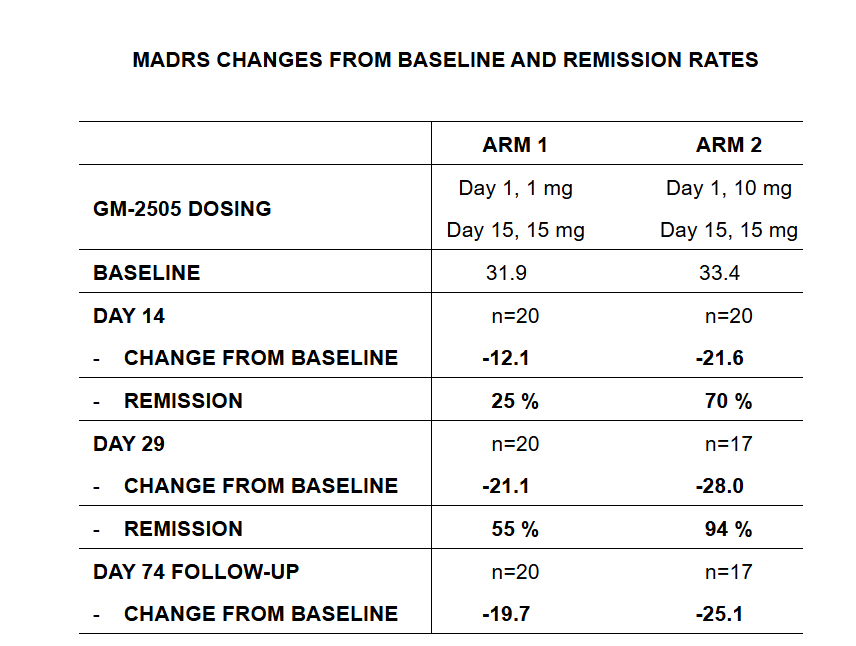
图17. Bretisilocin的临床试验结果
5.JJH201501
JJH201501是由吉贝尔利用其氘代药物研发技术平台研发的伏硫西汀衍生物,是一种新型的多受体作用机制的抗抑郁药,通过将伏硫西汀中甲基氢替换成氘来增强药物的稳定性,减缓代谢速度,从而达到增加药效、减少药物不良反应的目的(图18)。

图18. JJH201501的研发进展
JJH201501目前已完成了I期、IIa期和IIb期临床研究。2024年5月11日,由吉贝尔药业主办的“JJH201501片Ⅲ期临床研究全国研究者启动会”在北京成功举办。
目前,抗抑郁新药JJH201501正在有序开展Ⅲ期临床试验,按目前的计划,预计2025年完成Ⅲ期临床研究并提交上市申请。
6.LY03021
绿叶制药集团是一家致力于创新药物的研发、生产和销售的国际化制药公司。绿叶制药在抗抑郁症药物研发方面取得了显著进展,其核心产品若欣林®(盐酸托鲁地文拉法辛缓释片)是中国首个自主研发并拥有自主知识产权的抗抑郁1类创新药,于2022年12月获批上市(图19)。
若欣林通过其独特的三重再摄取抑制作用(SNDRI),全面改善抑郁症状,尤其对快感缺失、阻滞和认知障碍等改善突出,克服了现有药物的缺陷,且不引起失眠和嗜睡,不影响性功能、体重和脂代谢。
2025年8月18日,绿叶制药集团宣布若欣林用于治疗广泛性焦虑障碍的Ⅲ期临床试验已完成患者入组,预计2025年底提交上市申请。该试验为多中心、随机、双盲、安慰剂对照研究,以评估若欣林治疗广泛性焦虑障碍的安全。
LY03021是绿叶制药自主研发的1类创新药,通过靶向NET、DAT和GABAAR三个靶点发挥作用。该产品通过作用于突触内GABAA受体亚型α1β2γ2和突触外GABAA受体亚型α4β3δ,增强GABA对GABAA受体激活,调节脑内谷氨酸-GABA能平衡,抑制下丘脑-垂体-肾上腺(HPA)轴过度激活,快速发挥抗抑郁作用。
非临床研究显示,LY03021给药后24小时即显著改善模型动物的抑郁症状,且连续用药至21天疗效稳定,具有快速起效和疗效持久的优势。
2025年8月3日,LY03021在中国开展的I期临床研究已完成首例受试者入组。
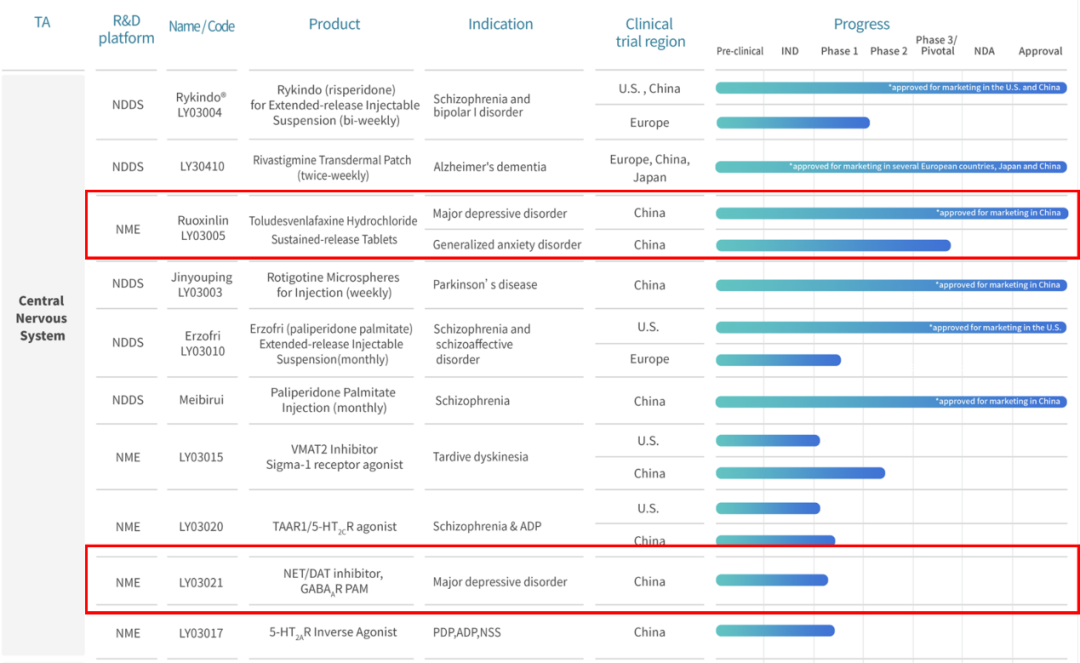
图19. 绿叶制药CNS管线
小结
抑郁症是一种常见的心理健康障碍,对患者的身心健康和社会功能等多方面造成严重危害,传统抗抑郁症药物在治疗抑郁症方面具有重要作用,但存在起效缓慢、副作用多、治疗反应差异大等缺点。这些缺点可能影响患者的治疗依从性和康复进程,因此仍需新颖机制的抗抑郁症药物。
随着抑郁症发病机制研究的深入,越来越多新颖机制的抗抑郁药物被开发,有望给患者更多的选择。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-16
2025-12-16
 17
17

 产业资讯
产业资讯
 药智网
药智网  2025-12-16
2025-12-16
 17
17

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-12-16
2025-12-16
 15
15