 会员动态
会员动态
 药智网
药智网  2025-09-06
2025-09-06
 439
439
继去年5月首次运用NewCo模式,将GLP-1管线成功license out给美国新兴biotech Hercules后,恒瑞医药再下一城,达成新的海外授权合作。
01
再次NewCo
今日(9月5日),恒瑞医药与美国Braveheart Bio公司达成独家许可协议,将其自主研发的心肌肌球蛋白(Myosin)小分子抑制剂HRS-1893项目在除中国大陆、香港特别行政区、澳门特别行政区及台湾地区以外的全球范围内开发、生产和商业化的独家权利有偿许可给Braveheart Bio。

图片来源:恒瑞医药官微
根据协议,Braveheart Bio将向恒瑞医药支付6500万美元首付款(含3250万美元现金和等值3250万美元的Braveheart Bio公司股权)和完成技术转移后的1000万美元近期里程碑款,总计7500万美元。此外,恒瑞医药还将收取最高可达10.13亿美元的与临床开发和销售相关的里程碑付款,及相应的销售提成。
此次授权的HRS-1893是恒瑞医药自主研发的1类创新药,是一种高选择性的心肌肌球蛋白小分子抑制剂,可特异性抑制心肌肌球蛋白ATP酶活性,使心肌收缩性能正常化,减少左心室肥厚并改善舒张期顺应性。
该药物目前正处于Ⅲ期临床开发阶段,用于治疗梗阻性肥厚型心肌病(oHCM),此前已获批开展用于肥厚型心肌病的临床试验,且其针对射血分数保留的心力衰竭的临床试验申请也已获得批准,而针对此适应症,国内外尚无同类药物获批上市。
从交易模式来看,此次授权延续了恒瑞医药的NewCo模式。
NewCo模式即新公司模式,是指将某一创新药项目授权给一家新成立的、专注于该药物研发和商业化的公司。这种模式有利于充分发挥双方的优势,恒瑞医药借助Braveheart Bio在海外的资源和渠道,加速HRS-1893在海外的研发和商业化进程,同时也能获得丰厚的收益,包括首付款、里程碑付款和销售提成等。而对于Braveheart Bio来说,则可以获得一款具有潜力的创新药,丰富其产品管线,拓展其在心血管领域的业务布局。
此次授权交易不仅为恒瑞医药带来了可观的经济收益,还有助于提升其在国际医药市场的影响力和品牌知名度,进一步推动其创新药物走向全球,为全球患者提供更多的治疗选择。同时,也体现了恒瑞医药在创新药物研发方面的强大实力和国际竞争力,以及其在NewCo模式运作上的成熟经验。
02
药物进展分析
肥厚型心肌病(HCM)是一种以左心室肥厚为突出特征的原发性心肌病,是最常见的遗传性心脏病,也是青少年和运动员发生心脏性猝死的首要原因。流行病学调查显示,全球肥厚型心肌病的患病率约为1/500,以此估算,全球患病人数众多。
目前,对于肥厚型心肌病的治疗需求尚未得到充分满足。
传统的治疗方法包括药物治疗、手术治疗等,但这些方法都存在一定的局限性。药物治疗方面,常用的药物如β受体阻滞剂、钙通道阻滞剂等,只能在一定程度上缓解症状,对心脏结构的改善作用有限;手术治疗则风险较高,且并非所有患者都适合手术。
近年来,随着对肥厚型心肌病病理生理机制的深入理解,以及药物研发技术的不断进步,针对该疾病的药物研发取得了显著进展。
心肌肌球蛋白抑制剂作为一种新型的治疗药物,受到了广泛关注。这类药物通过抑制心肌肌球蛋白的活性,从而减少心肌过度收缩,改善心脏舒张功能,为肥厚型心肌病的治疗带来了新的希望。
药智数据显示,目前全球仅有1款同靶点药物获批上市,即百时美施贵宝的Mavacamten(玛伐凯泰),该药物于2022年4月获FDA批准,并于2024年4月在中国获得上市批准,用于治疗NYHA心功能分级为Ⅱ~Ⅲ级的梗阻性肥厚型心肌病(oHCM)成人患者,2024年其销售额达到6.02亿美元,同比上涨161%。
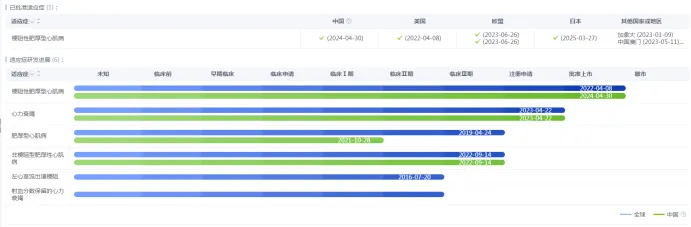
Mavacamten的适应症进展
图片来源:药智数据
此外,由Cytokinetics和箕星药业共同研发的Aficamten片也是一种第二代心肌肌球蛋白抑制剂,目前已在国内提交上市申请,2024年12月,FDA接受了Aficamten的上市申请,用于治疗梗阻性肥厚型心肌病(HCM),预计在2025年更新审评进展。
而恒瑞医药的HRS-1893作为国产首款进入Ⅲ期临床的心肌肌球蛋白抑制剂,具有重要的意义。
据恒瑞医药前不久在2025年欧洲心脏病学会(ESC)上披露的信息,HRS-1893-101,NCT07033455研究为一项多中心、随机、双盲、安慰剂对照的I期研究,分为四个部分,第一、二和三部分为健康受试者研究,第四部分为oHCM受试者多次给药剂量递增试验。第四部分研究纳入左心室射血分数(LVEF)≥60%的oHCM受试者,给药剂量为60 mg BID,连续给药14天。

HRS-1893-101 Part4研究设计
图片来源:恒瑞医药官微
研究共纳入8例oHCM受试者,其中6例受试者为HRS-1893组。
安全性:所有oHCM受试者对HRS-1893的耐受性良好,HRS-1893组所有不良事件均为轻度。无受试者在研究期间出现LVEF<50%。
药代动力学:oHCM受试者60 mg BID口服给药后,药物在给药第8天左右达到稳态,稳态下的峰浓度与给药间隔内的区域下曲线面积蓄积指数与健康受试者相当,分别为1.30、2.04。
有效性:HRS-1893 60 mg BID给药,可明显降低oHCM受试者左心室流出道压差(LVOT-G)水平,在第5天达到最低值,其中静息LVOT-G平均值为6.0mmHg;瓦氏(Valsalva)动作后LVOT-G在第5天达到最低值8.0mmHg,均降至oHCM治疗目标(LVOT-G<30mmHg)之下,且可维持至末次给药。
总体来看,HRS-1893在oHCM受试者中整体安全性良好,可以有效降低静息和Valsalva动作后LVOT-G,同时将LVEF维持在安全范围内。如若获批,将成为国产首款心肌肌球蛋白抑制剂。
结语:恒瑞医药此次将HRS-1893海外授权给Braveheart Bio,是其在NewCo模式下实现对外授权的又一成功案例,将为公司带来丰厚的收益,也为HRS-1893在海外的研发和商业化提供了有力支持。肥厚型心肌病药物市场具有广阔的前景,随着HRS-1893等在研药物的不断推进,有望为患者提供更有效的治疗方案,满足巨大的临床需求。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 163
163

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 161
161

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 182
182