 会员动态
会员动态
 丁香园Insight数据库
丁香园Insight数据库  2025-09-18
2025-09-18
 1240
1240
9 月 17 日,CDE 官网显示,恒瑞医药瑞康曲妥珠单抗的一项新适应症报上市,用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的局部晚期或转移性 HER2 阳性成人乳腺癌患者。此前该适应症已被 CDE 拟纳入优先审评,正在公示中。

截图来源:CDE 官网
瑞康曲妥珠单抗(SHR-A1811)是一种新型的靶向 HER2 的 ADC,由抗 HER2 抗体曲妥珠单抗、可裂解的连接子和拓扑异构酶 I 抑制剂载荷组成,药物抗体比为 6。
今年 5 月,瑞康曲妥珠单抗首次在国内获批上市,单药适用于治疗存在 HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者,成为首款获批用于治疗 HER2 突变 NSCLC 的国产 HER2 ADC,同时也是恒瑞首款商业化的 ADC 产品。
在 2024 年圣安东尼奥乳腺癌研讨会(SABCS)上,恒瑞披露一项瑞康曲妥珠单抗用于接受过大量治疗且 HER2 表达或突变的多种实体瘤患者的全球、多中心、首次人体 I 期研究数据。
结果显示,在肿瘤缓解疗效可评估的患者中,瑞康曲妥珠单抗治疗 HER2 阳性乳腺癌患者的 ORR 为 79.1%(95%CI,71.2-85.6),mPFS 为 20 个月(95%CI,15.1-NE),mDoR 为 23.6 个月(95%CI,15.6-NE)。

截图来源:Insight 数据库
在 2025 年 ASCO 大会上,恒瑞又以快速口头报告的形式公布了瑞康曲妥珠单抗在 HER2 阳性乳腺癌脑转移患者中的疗效与安全性结果。数据显示,瑞康曲妥珠单抗单药组的颅内缓解率为 84.4%,联合贝伐珠单抗组的颅内缓解率为 72.7%;两组未观察到新的安全性信号。
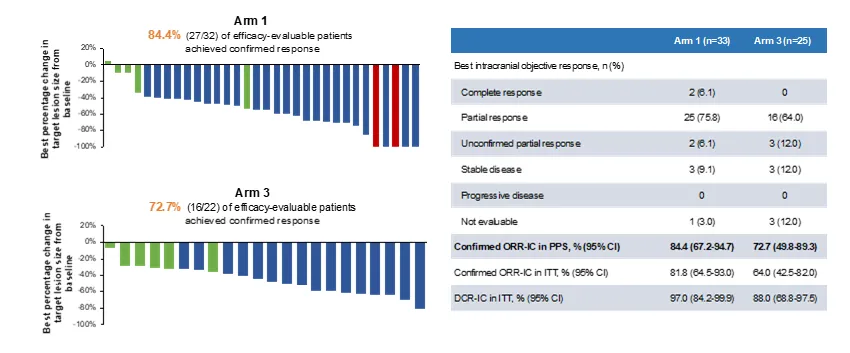
截图来源:企业官微
此外,恒瑞也在探索瑞康曲妥珠单抗用于 HER2 阳性早期乳腺癌新辅助治疗的效果。24 年 SABCS 上公布的一项前瞻性、II 期试验数据显示,瑞康曲妥珠单抗在 HER2 阳性早期乳腺癌新辅助治疗中,显示出有前景的抗肿瘤活性和可管理的安全性:瑞康曲妥珠单抗单药治疗病理完全缓解(pCR)率高达 63.2%,肿瘤退缩率达到 87.4%,且毒性安全可控。
此前,瑞康曲妥珠单抗已有 9 项适应症被 CDE 纳入突破性治疗品种名单,分别为:
用于 HER2 阳性的复发或转移性乳腺癌患者;
用于 HER2 低表达的复发或转移性乳腺癌;
单药治疗既往含铂化疗失败的 HER2 突变的晚期非小细胞肺癌(NSCLC)患者;
单药治疗既往经奥沙利铂、氟尿嘧啶和伊立替康治疗失败、HER2 阳性结直肠癌;
既往至少一线抗 HER2 治疗失败的 HER2 阳性晚期胃癌或胃食管结合部腺癌患者;
用于既往接受过一种或一种以上治疗方案的 HER2 阳性不可切除或转移性胆道癌患者。
治疗 HER2 表达的铂耐药复发上皮性卵巢癌、输卵管癌或原发性腹膜癌。
用于既往接受含铂化疗及免疫检查点抑制剂治疗失败的 HER2 表达(IHC≥1+)的复发或转移性宫颈癌。
联合阿得贝利单抗用于 PD-L1 阳性(CPS≥1)局部复发不可切除或转移性三阴性乳腺癌的一线治疗。

 会员动态
会员动态
 医药观澜
医药观澜  2026-01-29
2026-01-29
 162
162

 会员动态
会员动态
 先声药业
先声药业  2026-01-29
2026-01-29
 160
160

 会员动态
会员动态
 药怪站住
药怪站住  2026-01-28
2026-01-28
 181
181