 医改专题
医改专题
 医药云端工作室
医药云端工作室  2025-09-30
2025-09-30
 738
738
第11批集采昨天(9月28日)报名结束了,距离10月21日报价开标已经不足一个月,刨除国庆8天长假及周末休假日,有效工作时间更是不足20天,你都准备好了吗?
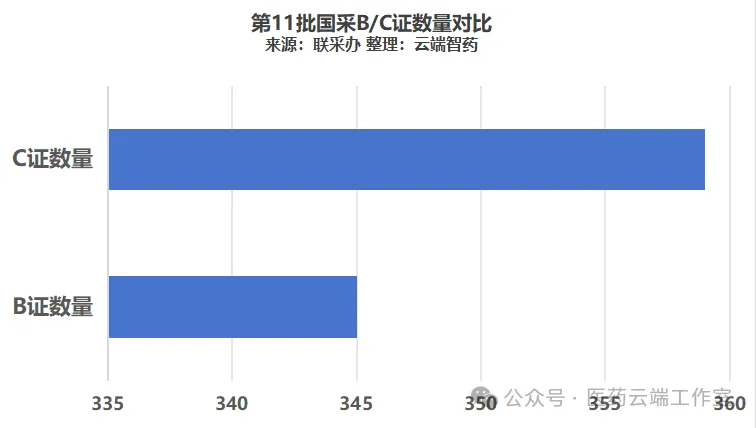
第11批国采B证数量占比为35%,报量规模为17亿元,占比15%
B证是集采受人关注的一个群体,自从2019年12月1日修订《药品管理法》、实施药品上市许可人制度(MAH)已经快满6年了。
这6年间,在MAH制度的推动下,药品生产许可证B证这一类企业,自己仅持有药品批件,而将生产委托给C证企业实现产证分离,因此,有B证就有C证,B证与C证相互依存,是医药行业的“并蒂莲”。
从第7批开始,就有大量的B证企业出现在集采中,第十批集采,有118个中选品种来自B证企业,占385个中选产品的30%,在234家中选企业中,B证企业有90家,占38.5%。
第11批国采,报量的1011条记录中,涉及委托生产的有354条记录,占按厂牌报量总数的35%。总报量规模为17.2亿元,占总报量金额的15%。当然,这其中不完全是纯B证企业,但B证企业尽管规模还算不上巨大,但企业数量在集采中占很大比重已经是不争之事实。
第11批国采报量B证345家,而C证则有359家,两证并不相等的背后,是一些企业存在多家委托生产的情况存在。
比如,南京方生和医药的达格列净就分别委托以岭万洲国际制药有限公司、江苏利泰尔药业有限公司生产;海思科医药集团委托海思科制药(眉山)有限公司、西藏海思科制药有限公司生产。
市场销量放大后,一家C证产能不能满足市场需求,就委托多家生产,这在政策上是允许的,同时也是MAH制度的精髓之一---合理规划产能、与市场合理对接,正是市场经济有效配置资源的体现。
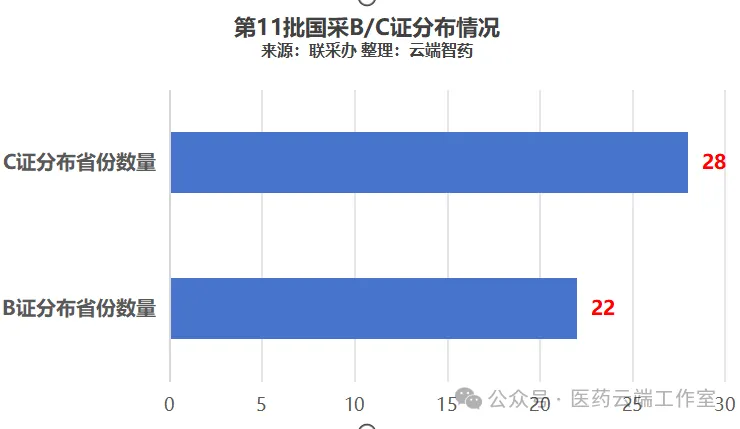
第11批国采,B证报量的企业分布于22个省市区,C证分布在28个省市区。
尽管B/C两证相互依存,但数量和分布不完全相同,B证显得更加集中,而C证则分散一些。主要原因是B证是近几年的新生事物,属于行业的增量,而C证多半是存量的生产能力,分布于全国各地。成为CMO,是未来很多同质化竞争下各类老工业的下一步发展方向。
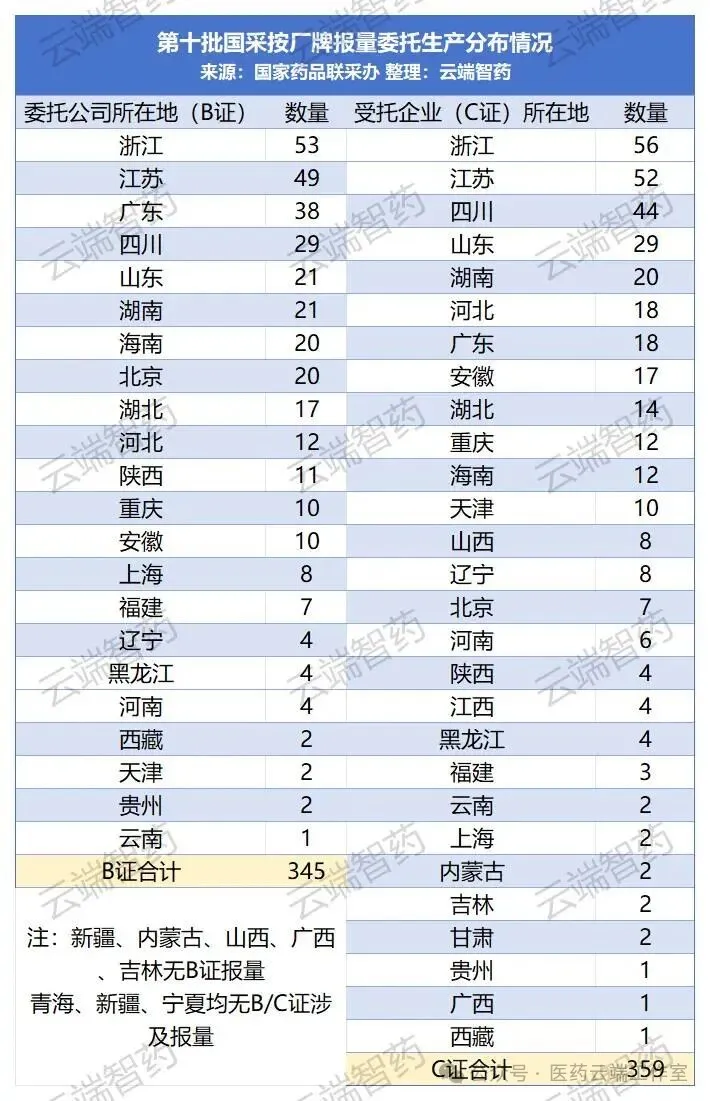
其中,浙江、江苏两省同时是BC两证的大省,浙江B证报量的企业53家,江苏49家,而C证则是浙江56家,江苏52家,可见江浙两地既是B证注册的大省,同时也是承接全国来受托生产的C证大省。
当然,江浙两省BC相互连同,本省申报批件,本省生产,得益于两省的产业政策,还有活跃的医药资源---资金、技术和生产能力。
四川、山东、湖南三省B、C两证都较为活跃,而广东B证较多,但C证偏少,生产能力的释放赶不上拿证的速度
除了江浙两地外,广东、四川、山东、湖南、海南也是此次第11批国采B证报量数量较多的省份,分别是38家、29家、21家、21家、20家。B证数量与当地经济发展、产业政策息息相关。
报量涉及C证受托生产数量较多的省份,则是四川、山东、湖南、河北、广东,分别是44家、29家、20家、18家、18家。C证与当地历史产能基础、产业政策有密切关系。
上海:第11批集采报量的BC两证数量乏善可陈
此外,我们也发现,上海作为国内药品研发、投融资及产业活动较为密集而活跃的城市,在集采报量的BC两证数量却乏善可陈---报量的B/C证分别只有8/2家。
其实也好理解,上海是具有国际视野的大都市,属于资金、技术和人才密集的城市,医药产业也是如此。
国采主要针对的是过专利期的原研药、仿制药,前者,上海倒是有很多这样的跨国企业和合资企业,但一般对集采并不积极;而后者---仿制药并不是上海着力打造的产业,上海主要聚焦在创新药、创新医疗器械领域,再加上上海开办企业各项成本也高于其他省市,对于仿制药的持证及承接生产,上海并没有优势。因此,第11批国采报量的B/C两证在上海较少也就容易理解。
西部地区BC两证数量稀疏,一些省区无BC证报量
第11批国采报量,不管是B证还是C证,主要集中在东部沿海省份,外加河北、山东、四川等仿制药基础雄厚的省份。西部偏远省份报量较少甚至没有报量,与当地的医药工业呈正相关。新疆、内蒙古、山西、广西、吉林无B证报量;而青海、新疆、宁夏均无B/C证涉及报量。
B证企业在集采中占比不容忽视,因此集采规则也不短迭代升级,与时俱进。
从第7批国采开始,采购政策就开始关注由MAH制度带来的影响,考虑企业之间的关联关系,其中包括A、B、C三证之间的委托、受托关系。
第11批集采规定,存在以下情形,涉及企业视为同一家申报企业:1)以下存在实控人为同一人或直接间接持股超过50%;2)工信部统计年报中确认的存在隶属关系;3)企业间存在品种批件转让;4)存在境外企业与境内代理人关系;5)企业将品种委托其他企业生产,该受托生产企业与该品种其他申报企业存在上述1-4列明的关系(即,A或B委托的C,与其他企业A1/A2...或B1/B2......存在上述情况);6)申报同品种的不同企业委托同一家企业生产的情形(即A1/A2/A3企业.....都委托C生产)。
此外,在集采准入条件上,也做了要求。集采规则要求投标企业或其委托生产企业有2年以上同类剂型生产经验,并且投标药品的生产线通过药品GMP符合性检查,生产线2年内未发生违反GMP的情况。
上述种种规则的调整,旨在“稳临床、保质量、防围标、反内卷”,毕竟,此前几批集采,都有一些企业因围标、生产质量、供应问题收到联采办的处罚,而此次第11批集采,从年初开始,就一步一步小心谨慎推进,确保集采运行顺利,创造更大的成果。

 医改专题
医改专题
 赛柏蓝
赛柏蓝  2026-02-28
2026-02-28
 119
119
 医改专题
医改专题
 中国医疗保险
中国医疗保险  2026-02-27
2026-02-27
 160
160
 医改专题
医改专题
 中国医疗保险
中国医疗保险  2026-02-26
2026-02-26
 208
208