 产业资讯
产业资讯
 2016-07-28
2016-07-28
 4531
4531
来源:识林 2016-07-28
7月26日美国FDA在联邦公报(FR)通告上公布了2017财年(2016年10月1日生效至2017年9月30日到期)GDUFA收费标准。计划提交简化新药申请(ANDA)和已获批申请的补充申请(PAS)的仿制药制造商将会发现在2017财年申请费率出现下降,而其它费率包括DMF和场地费与2016财年相比有所上涨。原始ANDA费和PAS费分别下跌约6000美元和3000美元。
FDA解释了费用的升高和降低,指出,对于ANDA和PAS费,相比2016年,FDA预期2017财年提交数量将有所增加。FDA估计2017财年约有891件新的原始ANDA和439件PAS提交。尽管2015财年递交的ANDA数量在GDUFA前五年期间是最低的,作为FDA估计2017财年提交的整体增长方面,2014财年接收1473件ANDA的记录在计算2017财年新的ANDA收费时肯定也发挥了作用。
DMF费比去年收费增加了17.6%,部分原因是由于进入GDUFA体系的新的DMF较少。原料药(API)和成品药(FDF)场地的小幅下滑逆转了去年我们看到的费用的下降趋势,上涨至GDUFA诞生以来的最高水平,部分原因是由于2017财年自我认定设施数量的减少。2017财年通过自我认定的FDF场地总数为675(2016财年实际注册厂地为690所),其中255所为境内场地,420所为境外场地;通过自我认定API场地总数为789(2016财年实际注册厂地为904所),其中101所为境内场地,688所为境外场地。)。
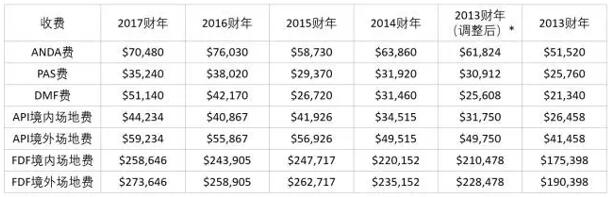
* 为方便读者对比每财年实际根据申请数计算得出的各项设施费及申请费,将2013财年收费做了“标准化调整”,按刨除5000万积压费后的收费总数2.49亿美元计算各项收费,即每项“调整”为原来的1.2倍(2.99/2.49=1.2)。
费用计算
FR通告还讨论了根据FDA对ANDA、PAS和DMF提交的估算对每种费用的计算,以及拒绝接收问题的费用返还,通货膨胀计算,完整申请等价数(FAE)。为计算ANDA费,FDA估计了将于2017财年提交的完整申请等价数(FAE),ANDA计为一个FAE,PAS计为半个FAE,因为PAS的费用为ANDA的一半。仿制药使用者付费法案还规定,如果申请由于未能付费之外的问题遭拒,需退还ANDA或PAS费用的75%。GDUFA原始总基本费用为2.99亿美元。按照通货膨胀率和居民消费价格指数调整得到的2017财年的总目标费用为$323,011,000(四舍五入到千元)。【识林资讯-GDUFA收费标准从哪里来?向哪里去?】
由于2017财年是GDUFA I期的最后一年,FDA可以进一步增加收费,并且如果这样的调整是必要的可以为2018财年前三个月准备不超过三个月的运行预备金,但FDA估计GDUFA计划将有超出三个月运行预备金的结转余额,因此FDA将不会执行最后一年调整。
请仿制药企业开始规划新的费用并将这些数字放入新财年的预算中。
整理:识林-椒

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 66
66

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 66
66

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 66
66