 产业资讯
产业资讯
 丁香园Insight数据库
丁香园Insight数据库  2025-11-15
2025-11-15
 9
9
11 月 14 日,NMPA 官网显示,罗氏制药 PD-L1 单抗阿替利珠单抗皮下注射剂在国内获批上市。
Insight 数据库显示,这是首个在国内获批的进口 PD-(L)1 皮下注射剂。不仅如此,之前在英国获批时,该药也是海外最早获批的一款 PD-(L)1 皮下注射剂。


截图来源:NMPA 官网
阿替利珠单抗是一种靶向 PD-L1 的单克隆抗体,自 2016 年在美国获批以来,该药已经获批超过 10 个适应症,覆盖非小细胞肺癌、小细胞肺癌、肝癌、乳腺癌、尿路上皮癌、黑色素瘤等癌种。作为 PD-(L)1 免疫治疗时代的一大明星药,其全球销售额在 2023 年度就已经达到 41.98 亿美元之高。
罗氏将阿替利珠单抗与 Halozyme Therapeutics 的 Enhanze 药物输送技术相结合,通过重组人透明质酸酶 PH20 (rHuPH20) 实现皮下制剂的开发。皮下制剂在依从性上有着巨大优势,可将注射时间从静脉注射的 30 - 60 分钟降低至 7 分钟,在疗效相似的情况下改善患者的用药体验、提高患者的用药满意度。
据 Insight 数据库显示,阿替利珠单抗皮下注射剂(阿替利珠单抗 SC)最早于 2024 年 9 月在英国实现全球首批,目前也已经在欧盟、加拿大、美国都获批上市。而国内上市申请则在 2024 年 7 月 27 日获受理,今日成功获批上市。
阿替利珠单抗 SC 的获批是基于 IMscin001 研究(登记号:NCT03735121/CTR20211387)的积极结果。其 Part 2 部分是一项全球多中心、III 期、开放标签、随机对照研究,探索了阿替利珠单抗 SC vs 静脉注射(IV)的暴露量、疗效和安全性。
结果显示,阿替利珠单抗 SC vs IV 的疗效和安全性一致。两者中位无进展生存期(mPFS)分别为 2.8 个月和 2.9 个月,中位总生存期(mOS)分别为 10.7 个月和 10.1 个月,不良事件(AE)发生率相似,未发现新的安全性信号。
关键临床结果

截图来自:Insight 数据库网页版
不仅如此,罗氏还曾开展研究探索患者对 SC 制剂和 IV 制剂的偏好度。IMscin002 研究纳入了 179 例患者,其结果显示,超过 70% 的患者倾向于选择阿替利珠单抗 SC;在满意度上,85.8% 的患者对 SC 满意。
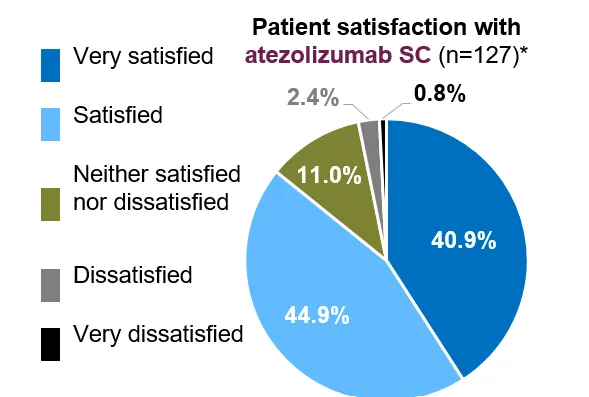
截图来自:2024 ELCC
后 PD-(L)1 时代,开发皮下注射剂正在成为各大药企抵抗专利悬崖、延长产品生命周期的重要剂型改良方向,也为患者提供更高的便利性和更多样的用药选择。不光已有 PD-(L)1 王牌产品的药企们纷纷将自家产品开发成皮下注射形式,后发的双抗项目也渐渐以双线并进的方式开局,同步推进静脉制剂和皮下制剂。
据 Insight 数据库显示,目前 PD(L)-1 皮下制剂项目已有十余款在临床开发当中。MNC 角度而言,默沙东的 K 药、BMS 的 O 药都已经被开发成皮下制剂,2024 年末 - 2025 年已经陆续在海外获批上市;辉瑞也开发了一款 PD-1 皮下注射剂 Sasanlimab,针对非肌层浸润性膀胱癌的 III 期临床积极结果已经公布。
国内 PD-(L)1 参与者们更是积极入局,百济神州、君实生物、恒瑞医药都把自家 PD-1 单抗都开发成皮下注射剂;恒瑞还开发了 PD-L1 阿得贝利单抗的皮下注射剂。
不过,罗氏在皮下注射剂的布局上可以说是相当早、也相当成熟。在肿瘤领域,罗氏合作 Halozyme 公司,目前有多达 9 个皮下注射抗体药项目在开发,7 款都已经获批上市。
尤其在 HER2 帕妥珠曲妥珠单抗注射剂(Phesgo,赫捷康®)上已经取得成功,已有静脉注射患者群体不断向皮下注射转换,在抵御昔日「三驾马车」专利悬崖上卓有成效。Phesgo 在 2024 年度已经实现 19.72 亿美元销售额,同比大增 58%。

 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-11-17
2025-11-17
 7
7

 产业资讯
产业资讯
 一度医药
一度医药  2025-11-17
2025-11-17
 6
6

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-17
2025-11-17
 7
7