 产业资讯
产业资讯
 药智网
药智网  2025-12-02
2025-12-02
 6
6
近年来,心血管疾病治疗领域正经历一场深刻变革。PCSK9和Lp(a)两大新兴靶点脱颖而出,成为跨国药企竞相布局的热门赛道,引领心血管疾病治疗进入全新的黄金时代。
1
迎来两大黄金靶点
动脉粥样硬化性心血管疾病(ASCVD)是由动脉粥样硬化引起的一组累及全身血管和心脏的疾病总称,涵盖冠心病、脑血管疾病及外周动脉疾病等。ASCVD是全球首要致死原因之一,全球疾病负担研究显示,缺血性心脏病在1990年与2021年始终位列全球死因首位。
在中国,成人血脂异常患者约5亿,其中高胆固醇血症患者约1.2亿。他汀类药物是血脂异常降脂药物治疗的基石用药,通过抑制胆固醇合成限速酶,减少胆固醇合成,同时上调细胞表面LDLR,加速血清LDL分解代谢。但是,他汀类药物剂量增倍,LDL-C降低效果只增加6%。此外,他汀亦存在肝酶异常、肌病与新发糖尿病等安全性风险,加之需每日服药所带来的依从性差、停药率高等问题,均限制了其临床获益。研究显示,停用他汀会显著增加心血管事件复发风险。
当他汀类药物无法使患者LDL-C达标时,联合治疗成为必然选择。根据中国血脂管理指南,中等强度他汀可使LDL-C下降25%–50%,而联合非他汀类药物如胆固醇吸收抑制剂或PCSK9抑制剂,则可进一步将降幅提升至50%–70%,在他汀类药物治疗基础上进一步减少主要不良心血管事件。对于部分基线LDL-C水平较高或他汀不耐受的超高危患者,早期联合PCSK9抑制剂可实现更快速、更持久的血脂达标,并为患者带来明确的心血管保护效益。
Lp (a)升高是动脉粥样硬化性心血管疾病的独立风险因子,截至目前,全球范围内尚未有获批的特异性降低 Lp (a) 水平的药物。Lp (a) 同时具备促炎症反应与加速动脉粥样硬化的双重作用,其水平主要由遗传因素决定,传统降脂方案难以对其进行有效调控,因此,研发靶向 Lp (a) 的治疗手段,已成为心血管疾病防控领域的全新研究方向。
在这样的临床需求驱动下,全球制药企业纷纷将研发重心投向新型降脂靶点。根据药智数据库,当前全球心血管药物研发管线中,PCSK9与Lp(a)已成为制药企业布局的两大重点靶点。跨国药企如礼来、诺华、默克等均在积极推进针对这两大靶点的药物,一场围绕新型降脂靶点的研发竞赛已然拉开序幕。
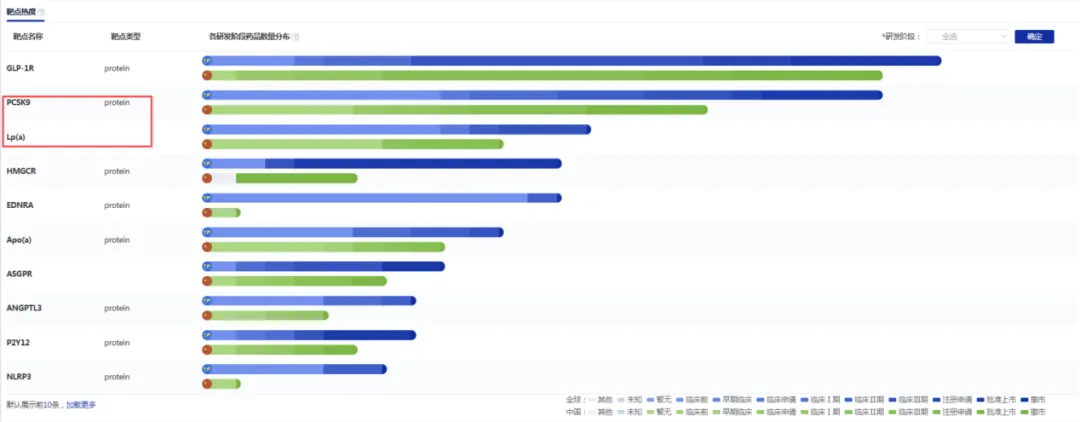
全球心血管领域新药研发靶点分布
数据来源:药智数据-全球药物分析系统
2
PCSK9靶点:多技术路径并进
目前全球已有6款PCSK9单抗药物上市,1款siRNA药物获批,在研产品覆盖单抗、siRNA、小分子、口服环肽乃至基因编辑疗法,呈现出多技术路径并进的研发格局。
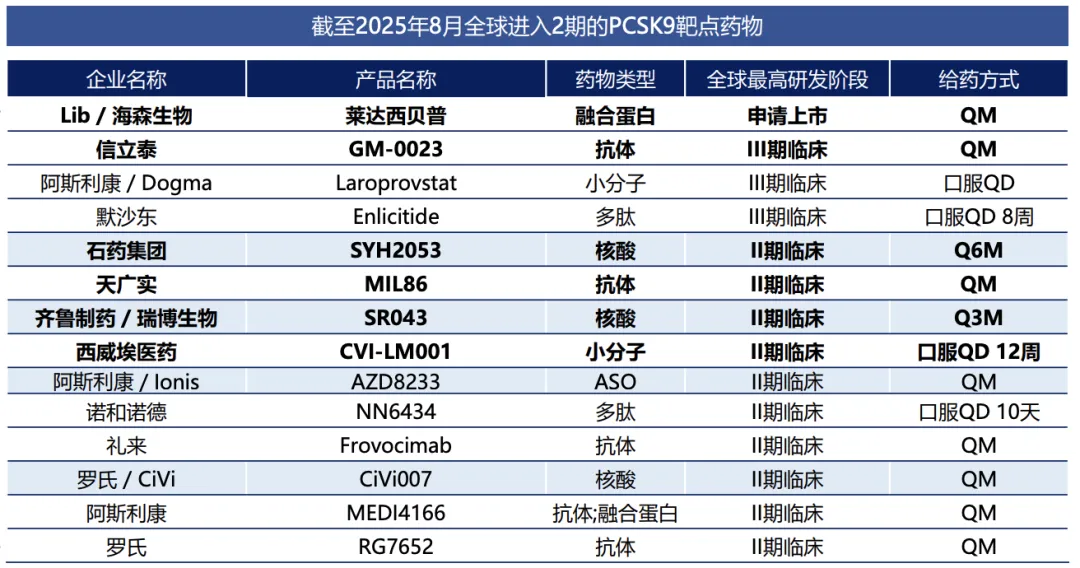
图片来源:东吴证券
长期以来,PCSK9抑制剂这类新型降脂药的研究,多聚焦于既往发生过心梗、卒中等重大动脉粥样硬化性心血管事件的高危人群。而对于尚未发生此类严重事件,但同样具备高危因素的患者,这类药物的实际作用一直缺乏大规模临床证据支持。
PCSK9单抗依洛尤单抗的VESALIUS-CV研究填补了这一空白,在无心肌梗死或卒中病史的高危人群中,依洛尤单抗同样能显著降低首次主要不良心血管事件(MACE)的发生风险。结果显示,3点MACE风险下降了25%(HR 0.75),4点MACE风险下降19%(HR 0.81)。
安进的依洛尤单抗是全球首款PCSK9抑制剂,商业化表现亮眼,2023年销售额达16.35亿美元,2024年同比增长36%至22.22亿美元,仍处于高速成长期。
相比单抗需每2-4周注射一次的频率,PCSK9 siRNA药物通过RNA干扰机制降解肝脏中的PCSK9 mRNA,从源头减少PCSK9蛋白产生,实现了更长效的降脂效果。
诺华与Alnylam合作开发的英克司兰钠注射液,是全球首个获批的PCSK9长效siRNA制剂。给药方案上,该药物首针后三个月注射加强针,此后每年仅需注射两针,大幅提升患者依从性。从疗效上看,英克司兰钠注射液的关键Ⅲ期数据显示,治疗510天后患者LDL-C水平较基线降低52.3%,且安全性良好。
英克司兰钠注射液已在美国和中国获批,销售额快速增长,2023年达3.55亿美元,2024年翻倍至7.54亿美元。目前诺华仍在推进英克司兰钠在心血管一级和二级预防中的应用,进一步拓展市场边界。
口服PCSK9抑制剂方面,默沙东的Enlicitide(MK-0616)与阿斯利康的Laroprovstat(AZD0780)进展较快,目前两款药物均处于Ⅲ期临床阶段。
默沙东的MK-0616是可通过消化道吸收的合成小分子环状肽类,关键Ⅲ期CORALreef Lipids试验结果显示,在已接受稳定降脂治疗或他汀不耐受的ASCVD患者中,每日一次给药24周后,LDL-C较安慰剂组降低55.8%(P<0.001),疗效显著。
阿斯利康的AZD0780则在口服生物利用度上更具优势,可灵活调整空腹或饭后给药。AZD0780的Ⅱb期PURSUIT研究显示,在标准他汀治疗基础上,每日以此30mg剂量AZD0780治疗12周,治疗组患者LDL-C较安慰剂组降低50.7%;此外,84%的用药组患者达到指南推荐的目标值LDL-C<70mg/dL,而安慰剂组仅13%。
在长效化基础上,基因编辑技术正推动PCSK9靶点治疗向“一次性治愈”迈进。2025年6月,礼来以13亿美元收购Verve Therapeutics,获得PCSK9体内编辑疗法VERVE-102。该药物通过脂质纳米颗粒(LNP)递送腺嘌呤碱基编辑器(ABE),可永久关闭肝脏中PCSK9基因的表达,从根本上阻断PCSK9蛋白产生。
VERVE-102的Ⅰb期Heart-2研究的积极数据显示,4 例接受最高剂量(0.6 mg/kg)单次静脉输注的患者,LDL-C平均降低53%,最高降幅达69%。尽管基因编辑疗法仍面临长期安全性与给药技术的挑战,但这一方向为心血管疾病的根治提供了全新可能。
3
Lp (a)靶点:巨头竞逐
目前全球尚无特异性Lp(a)降低药物获批,但包括反义寡核苷酸(ASO)、siRNA与口服小分子在内的多条路径已进入后期临床,成为心血管领域最受关注的新兴赛道之一。
诺华的Pelacarsen是一款GalNAc偶联的ASO药物,通过与apo (a) mRNA互补结合介导其降解,为全球首个进入Ⅲ期的Lp (a)靶向药物。该药由Ionis授权引进,诺华为此支付了7500万美元预付款、最高8.25亿美元里程碑付款及销售分成。
Pelacarsen的 Ⅱ期临床数据显示,60mg每4周注射一次或20mg每周注射一次,可分别降低Lp (a) 水平72%和80%,安全性良好。目前其Ⅲ期HORIZON试验已纳入8325名心血管疾病患者,评估降低Lp (a)对MACE事件的影响,预计2026年上半年读出数据,2026年下半年递交NDA,有望成为首款获批药物。
安进的Olpasiran是针对LPA mRNA的siRNA药物,单次注射可维持12周疗效。其Ⅱ期OCEAN (a)-DOSE研究显示,225mg剂量每3个月注射一次,48周时Lp (a)水平降低101.9%,96周时仍维持36.4%的降幅,长效性优势显著。该药目前正在开展Ⅲ期 OCEAN (a) 结局试验,进一步验证其心血管获益。
礼来的Lepodisiran(siRNA)采用每6个月一次的给药频率。该药物是礼来从Dicerna(后被诺和诺德以33亿美元收购)授权引进的,交易总额达5.5亿美元。其Ⅱ期ALPACA研究显示,单次或两次给药后,60天至180天内Lp (a)水平平均降低93.9%,其中96mg剂量组降幅达75.2%,预计2029年完成Ⅲ期临床。
在核酸类药物凭借长效性冲刺首发的同时,口服小分子Lp (a)抑制剂凭借给药便利性,成为赛道上的另一股核心力量。这类药物通常无需注射给药,更易被患者接受。
礼来自主研发的Muvalaplin是该方向的代表药物,该药物通过阻断apo(a)与apoB的结合,抑制Lp(a)组装。Muvalaplin的Ⅱ期数据显示,每日口服剂量为10mg、60mg 或240mg,持续12周后,相比安慰剂,传统检测法测得Lp (a)最大降幅达70%,完整Lp (a)颗粒检测法测得最大降幅达85.5%;60mg和240mg剂量组中,分别有95.9%和96.7%的患者Lp (a)水平低于125nmol/L,而安慰剂组仅6.0%。
这一赛道前景广阔,引发了跨国药企的密集合作。2024年10月,阿斯利康与石药集团达成协议,以1亿美元首付款+19.2亿美元里程碑金额引进临床前小分子Lp(a)抑制剂YS2302018,计划未来与口服PCSK9抑制剂AZD0780联用。2025年3月,默沙东以总金额19.7亿美元获得恒瑞医药口服小分子抑制剂HRS-5346的全球权益。
4
结 语
从传统他汀到PCSK9与Lp(a)靶向药物,血脂管理正经历一场深刻的变革。PCSK9靶点已通过多技术路径实现从注射到口服、从短期给药到长效治愈的迭代,为他汀不耐受或不达标的患者提供了多元化选择;在Lp (a)靶点的研发上,核酸类与口服小分子药物的双线竞争,有望为全球14亿患者带来首个针对性疗法。
未来,随着更高效递送技术的发展,ASCVD的治疗将朝着更高依从性、更广泛人群获益等方向迈进。对于行业而言,这两大靶点的持续突破,将重塑全球心血管药物市场的竞争格局,为创新药企带来广阔的成长空间。

 产业资讯
产业资讯
 医麦客
医麦客  2025-12-02
2025-12-02
 5
5

 产业资讯
产业资讯
 药时代
药时代  2025-12-02
2025-12-02
 5
5

 产业资讯
产业资讯
 动脉网
动脉网  2025-12-02
2025-12-02
 5
5