 产业资讯
产业资讯
 医麦客
医麦客  2025-12-02
2025-12-02
 7
7
今年,在 BD 的带动下,国内抗体赛道热度空前。康方生物、科伦博泰等凭借核心管线首次突破千亿市值,恒瑞医药、映恩生物等家头部玩家扎堆港股上市,资本市场认可度持续攀升。
而经过近十年技术蛰伏,百利天恒、乐普生物等已实现盈利,充分印证中国抗体领域的产业实力与临床价值。于此同时,抗体的应用边界也在不断拓宽。
当下,抗体已跳出单纯治疗分子范畴,正进化贯穿多种疗法的「精准靶向核心」。从 in vivo CAR 细胞疗法、AAV 基因治疗的靶向修饰,到 ADC 之后 AOC、ARC、ABC、ACC 等新型偶联技术的精准定位,其高特异性靶向优势正全面赋能创新药开发进入新时代。
In vivo CAR 细胞疗法
In vivo CAR-T 凭借「现货通用生产、无需清淋化疗」的核心优势,破解了传统 CAR-T 规模化应用的关键瓶颈,吸引阿斯利康、艾伯维、吉利德、BMS 等 MNC 重金布局。
目前全球已有超 20 家企业入局该赛道,部分管线已进入早期临床阶段,核心技术路线多聚焦慢病毒载体与 LNP 递送系统两大方向。
慢病毒介导 CAR
慢病毒载体凭借高转导效率成为 in vivo CAR-T 研发热点,进度领跑行业。Interius(被吉利德收购)、Umoja、EsoBiotec(被阿斯利康收购)等全球第一梯队企业均聚焦该路线,且多用抗体修饰病毒载体以提高其靶向性。
Interius Bio 通过阻断水泡性口炎病毒糖蛋白 G(VSVG)与 LDL 受体的天然结合,在病毒表面融合 CD7 结合分子,实现 T/NK 细胞定向转导,核心管线 INT2104(治疗 B 细胞恶性肿瘤)已进入 Ⅰ 期临床;Umoja 核心平台 VivoVec™ 则是在慢病毒表面表达靶向 CD3 抗体,以靶向 T 细胞。
在国内,普瑞金凭借与 EsoBiotec(被阿斯利康收购)合作开发的 ESO-T01 进度领先,ESO-T01 采用纳米抗体靶向、免疫屏蔽的慢病毒递送载体,可将人源化抗 BCMA 单域抗体 CAR 递送至体内,以工程化改造 T 细胞。在设计上,通过突变 VSVG 关键残基,规避慢病毒对哺乳动物的广谱嗜性;在病毒膜高表达 CD47(抑制单核吞噬系统吞噬),并整合 TCR 纳米抗体,实现 T 细胞特异性靶向。
今年 7 月 2 日,ESO-T01 治疗在 4 例复发/难治性多发性骨髓瘤(RRMM)患者中的完整临床数据首次发布于《The Lancet》。截至 2025 年 4 月 1 日,患者 1 在 2 个月时达到严格完全缓解(sCR),髓内及髓外病灶完全消退;患者 2 在 28 日达到 sCR,病灶完全消退;患者 3、4 获得部分缓解(PR),28 日时肿瘤负荷缩小,骨髓微小残留病灶(MRD)阴性。
LNP 介导 CAR
相较于慢病毒,LNP 递送具有 CAR 表达瞬时性、不整合基因组的独特优势。
Capstan(被艾伯维收购)的靶向 LNP(tLNP)平台,通过抗体修饰实现 CD8+ T 细胞特异性结合,避免误伤其他免疫细胞。此外采用新型离子化脂质 L829,减少非特异性递送,降低肝毒性;优化非翻译区(UTR)和密码子大幅提升 CAR 表达效率。
发表于《Science》的研究显示,基于 CD8-L829-tLNP 递送 CAR mRNA 的 in vivo CAR-T 技术可在人源化小鼠模型和非人灵长类模型体内优先改造 T 细胞,以快速、深度清除 B 细胞,导致免疫重置,产生持久的治疗益处,为 CAR-T 细胞治疗 B 细胞恶性肿瘤及自身免疫疾病提供一种新方案。
虹信生物是国内 in vivo CAR-T & 工程化细胞靶向递送领军企业,核心工程化细胞靶向递送平台(EnC-LNP)旨在解决 mRNA 肝外及非 APC 靶向递送限制。基于 EnC-LNP 技术开发的 HN2301 核心成分由自主知识产权的可离子化氨基脂质(ILB-3132)、人源化的 CD8 靶向抗体片段以及自主知识产权的 Anti-CD19 CAR mRNA 组成,拟用于治疗系统性红斑狼疮。
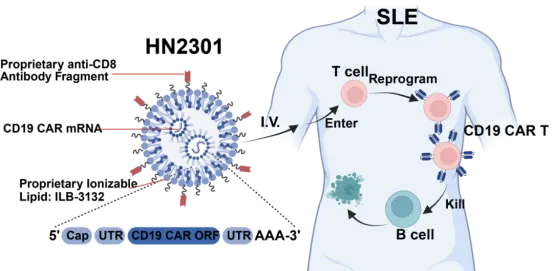
相关研究发表于《NEJM》:首例患者单次低剂量(2 mg)给药 6 小时后,外周血 CAR-T 占比达 10%,B 细胞降至给药前 10%;3
次给药方案可重复诱导 CAR-T 生成,但未实现 B 细胞清零,初步验证安全性与疗效。
AAV 基因治疗
AAV 是基因治疗领域主流病毒载体,凭借高安全性、低免疫原性等优势被广泛应用,但系统性给药后易在肝脏大量富集,既降低靶向组织有效剂量,又可能引发肝毒性,成为技术研发与商业化的核心瓶颈。而通过抗体修饰优化 AAV 衣壳靶向性,有望为组织特异性递送提供关键解决方案。
今年 10 月,日本 JCR 制药的 JUST-AAV 衣壳工程平台取得里程碑突破。该技术核心是在 AAV 衣壳表面嵌入微型化抗体片段,使其可特异性识别结合肌肉、脑组织等目标组织受体。小鼠实验显示,新型 JUST-AAV 在股四头肌转导效率达 AAV9 的 28 倍,心脏转导效率达 52 倍,肝脏转导效率却 AAV9 降低 160 倍。
5 月,克睿基因公布细胞靶向 AAV 技术专利。该技术采用理性设计,通过反转传统偶联元件思路绕开专利壁垒,可在每个 AAV 衣壳表面定量修饰 5 个抗体片段。目前,该公司已成功开发靶向 T 细胞、肿瘤的载体,且通过简单替换抗体片段,有望拓展至脑神经细胞、心肌细胞、特定免疫细胞等多种组织靶向场景。
ACC
抗体-细胞偶联药物(ACC)技术通过将精准靶向抗体与效应细胞结合,以强化细胞靶向性。国内企业在该赛道进展显著,在研产品聚焦 NK 细胞与红细胞偶联。
英百瑞生物凭借自主研发的非病毒、非基因修饰技术平台领跑 ACC-NK 领域。全球首款靶向 TROP2 的 CAR-raNK 细胞注射液 IBR822,通过化学共价偶联 TROP2 特异性抗体与 NK 细胞,兼具高安全性与强效杀伤活性。
国内首个针对实体瘤的 ACC-NK 疗法 IBR854,以 5T4 为靶点,通过 linker 实现抗体与同种异体 NK 细胞偶联,既增强杀伤活性又提升靶向性。今年 8 月 IBR854 联合培唑帕尼用于晚期肾细胞癌的 Ⅱ 期临床研究正式启动。此外,英百瑞生物还布局了 CD33/CLL1 双特异抗体偶联的 IBR733 等多款通用现货型候选产品。
西湖生物医药 WTX-212 是全球首个工程化红细胞偶联 PD-1 抗体,利用红细胞与免疫系统在身体内的紧密接触,通过工程化红细胞使其携带免疫药物,在患者体内高效激活免疫细胞,并且系统性诱导抗肿瘤免疫反应。
今年 ASCO 公布数据显示,WTX-212 单药治疗多例免疫耐药泛实体瘤患者实现了客观缓解(ORR),其中包括两例患者实现 CR,且总体中位总生存期(mOS)远超现有疗法。
小核酸
小核酸凭借抗肿瘤免疫激活、基因表达调控及治疗性蛋白编码等优势,在肿瘤、感染性疾病及遗传病领域前景广阔,但面临血清核酸酶降解、生物利用度低、脱靶毒性高等核心痛点。
LNP 虽经新冠 mRNA 疫苗验证安全性与可行性,成为主流核酸递送方式之一,却存在易肝脏富集、肝外器官(肺、脑等)递送效率低、组织/细胞特异性不足等局限。而抗体修饰 LNP 可借助靶向性突破这一瓶颈,AOC 便是典型实践。
AOC 将单克隆抗体技术与寡核苷酸疗法(siRNA、PMO、ASO 等)相结合,一个靶点的抗体(或 Fab 片段)结合不同的核酸药物可用于治疗不同的疾病。Dyne Therapeutics、Denali Therapeutics、Tallac Therapeutics 等海外企业,以及迦进生物、盛世君联、成都先导等国内药企均布局该赛道。
Avidity 是 AOC 领域的先驱 Biotech,其核心 AOC™平台通过优化靶向端(覆盖抗体、环肽、脂质等载体)与 siRNA 修饰端,显著提升递送效率并延长基因沉默持续时间。今年 8 月,诺华以 120 亿美元收购 Avidity,强化其神经肌肉疾病管线。
Avidity 还手握 3 款 Ⅲ 期临床管线,适应症分别为 1 型强直性肌营养不良(DM1)的 AOC Del-Disiran(AOC1001);用于治疗面肩肱肌营养不良病(FSHD)的 AOC Del-Brax(AOC 1020);以及用于治疗杜氏肌营养不良症(DMD)的 AOC Del-Zota(AOC1044)。其中,Del-Zota 进度最快,有望明年获 FDA 批准上市。
Dyne 与 Avidity 布局类似,其核心管线 DYNE-101 由靶向 TfR1 抗体与 ASO 偶联而成,适应症为 DM1,该公司预计明年年底向 FDA 提交 BLA。
国内迦进生物进展领先,其自主研发的 TfR1 抗体-人 DMPK siRNA 偶联药物(CGB1001)已获 FDA 的孤儿药资格认定(ODD),且有望成为国内首款针对 DM1 的疾病修饰疗法。CGB1001 基于公司 ARC 平台开发,该平台高亲和力,高选择性 TfR1 专利抗体,对标 Avidity 的 13E4 抗体,主要用于靶向肌肉递送小核酸药物。
ARC
抗体-放射性核素偶联药物(ARC)作为核药的一种类型,由抗体、连接子、螯合剂及放射性核素构成,其核心差异在于通过螯合剂实现放射性金属与靶向抗体的稳定结合,避免核素泄漏导致的骨髓、脾脏等正常器官毒性,较传统 ADC 更具靶向安全性。
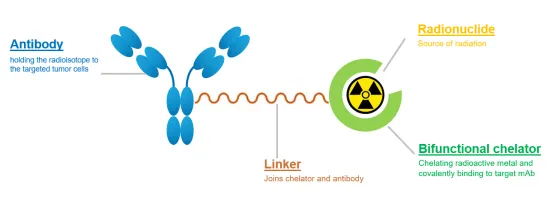
治疗性放射性核素按辐射特性可分为 β 粒子、α 粒子及俄歇电子发射体,其中 α 粒子生物杀伤效力更高,且无 β
粒子的非特异性旁观者效应,临床优势显著。
迄今为止,全球已获批/曾获批上市的治疗性 ARC 仅 4 款,包括 Zevalin(抗 CD20+90Y)、已退市的 Bexxar(托西莫单抗+131I)、唯美生及利卡汀。
在研管线中, Telix/远大医药的 TLX591、阿斯利康/Fusion 的 FPI-1434、拜耳的 BAY-3547926、强生的 JNJ-69086420、百利天恒的镥 [177Lu]-BL-ARC001 、博锐创合的 BR-11 均已进入临床阶段。
其中,TLX591 进展最快,2025 年 5 月在中国完成 Ⅲ 期临床试验全部患者入组给药。其以 PSMA 为靶点,利用单克隆抗体作为高特异性定位装置,搭载治疗性放射性核素 177Lu 精准输送至肿瘤部位,同时脱靶器官暴露率显著降低,拟用于治疗既往接受过 ARPI 治疗进展 PSMA 阳性 mCRPC 患者。
相比市面上长达六周期、持续 30 周的 PSMA 靶向放射性配体治疗 (RLT),TLX591 仅需间隔约 14 天的双剂给药方案,大幅缩短治疗周期,显著提升患者依从性及便利性。鉴于 TLX591 已展现出超越现有抗 PSMA 小肽 RLT 分子的临床潜力,有望重新定义 PSMA 阳性 mCRPC 的治疗标准。
ABC
抗体-瓶刷前药偶联物(ABC)由抗体与瓶刷前药(BPD)构成。BPD 像一个「分子刷子」,能够灵活挂载不同类型的药物分子,包括临床常见的 MMAE、SN-38,也包括传统上无法用于 ADC 的 DOX(阿霉素)、PTX(紫杉醇),甚至还可以搭载 PROTAC 分子 ARV771 或成像探针 Cy5.5。
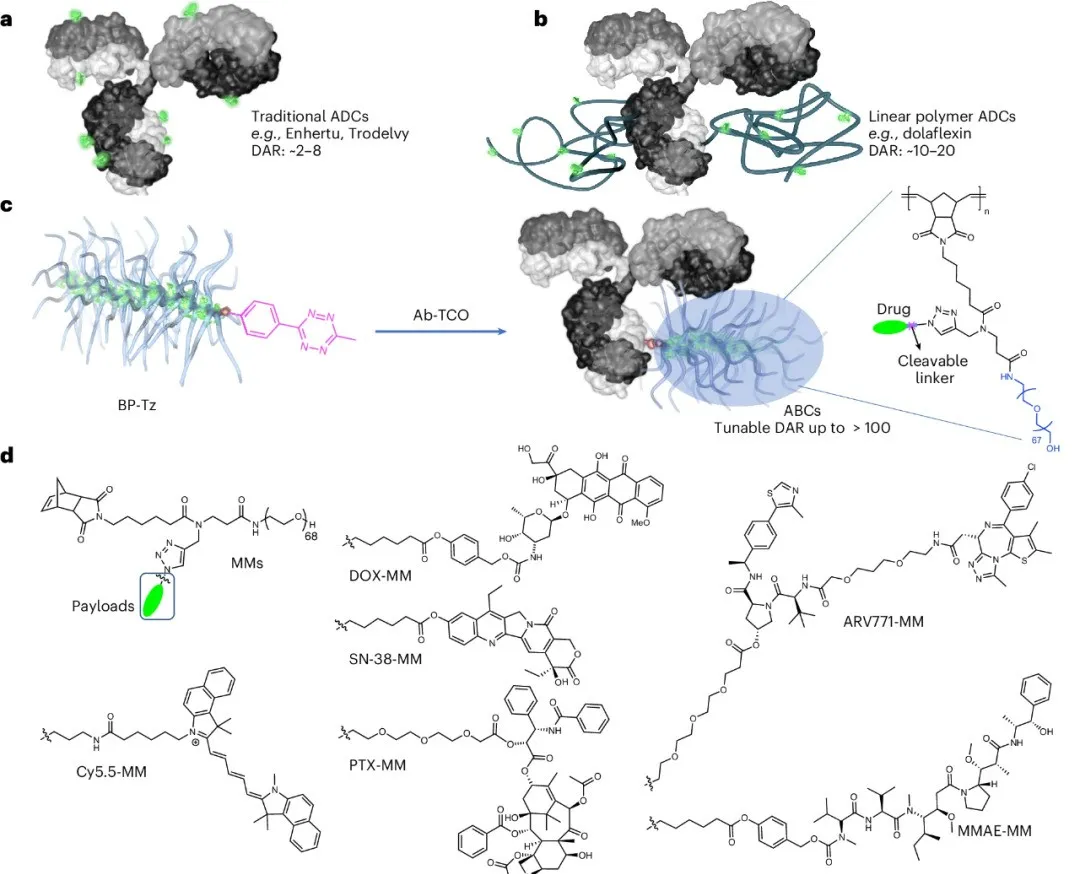
该技术由麻省理工学院团队于今年 9 月在《Nature Biotechnology》发表。通过将抗体与 BPD 结合,研究人员实现了远超传统 ADC
的超高 DAR(可达 135,是现有 ADC 的 10-100 倍),不仅大幅提升了载药量,还显著拓宽了 payload
的适用范围,让更多低效价药物有重获进入靶向治疗的机会。
研究人员还将 BET 蛋白降解剂 ARV771 引入 ABC 体系,构建了全球首个 PROTAC-ABC。结果显示,ARV771-HER2 不仅在体内展现了显著抗肿瘤活性,且所需剂量远低于游离 PROTAC,为解决 PROTAC 药代动力学差、递送效率低的核心痛点提供了创新方案。
ATTC
不同于传统 ADC,和黄医药 ATTC 技术平台采用靶向小分子抑制剂(如蛋白互作抑制剂、蛋白降解靶向嵌合体)作为 payload,提高安全性的同时,也可以克服对于化疗的耐药性,且有望联合化疗,推动在更早线治疗中使用。
该平台首发管线 HMPL-A251 靶向 PI3K/AKT/mTOR(PAM)-HER2 抗体,由高选择性、强效的 PI3K/PIKK 抑制剂作为有效载荷和人源化抗 HER2 IgG1 抗体通过可裂解的连接子偶联而成。近期已在国内获批临床。
结语
全球创新药领域,抗体已从「治疗分子」升级为「精准导航核心」。继 ADC 后,AOC、ACC、ARC、ABC 等技术加速突破,既破解传统疗法递送瓶颈,更催生多项临床革新。
当前仍需攻克靶点优效性、连接子时空释放、实体瘤穿透三大挑战。未来,AI 与多组学、蛋白质工程深度融合将催生「智能导航抗体」,以抗体为基石的递送技术将持续引领从「精准治疗」向「智能治疗」的范式变革。

 产业资讯
产业资讯
 医麦客
医麦客  2025-12-02
2025-12-02
 7
7

 产业资讯
产业资讯
 药时代
药时代  2025-12-02
2025-12-02
 7
7

 产业资讯
产业资讯
 动脉网
动脉网  2025-12-02
2025-12-02
 6
6