 产业资讯
产业资讯
 药智网
药智网  2025-12-19
2025-12-19
 15
15
近日,葛兰素史克(GSK)宣布其超长效IL5单抗Exdensur(depemokimab)获得FDA批准上市,作为附加维持疗法,用于治疗12岁及以上、具有嗜酸性粒细胞表型的成人和青少年严重哮喘患者。
就在前一天,该药获得英国药品和医疗保健产品监管局(MHRA)批准上市,用于治疗两项适应症,包括哮喘和慢性鼻窦炎伴鼻息肉(CRSwNP)。
该药仅需每6个月给药一次,对于慢病治疗意义重大,曾被行业媒体Evaluate评估为2025年“潜在重磅药物”。
01
疗效“超长待机”
传统慢性炎症性疾病的生物制剂治疗,往往需要每2至8周进行一次皮下或静脉给药,这种频繁注射不仅给患者带来极大的身体负担,也造成依从性难题。
Depemokimab是全球首个且唯一获批的靶向IL5的超长效生物制品。该药通过在Fc段或重链序列上做了特定替换,改善与胱苷糖蛋白受体(FcRn)的相互作用或减慢清除,从而延长循环半衰期,将给药间隔延长至半年,实现了疗效的“超长待机”。
其哮喘适应症的获批是基于SWIFT(SWIFT-1和SWIFT-2)研究数据。结果显示,与安慰剂相比,接受每年两次的depemokimabr治疗,可持续降低哮喘急性加重发生率。在SWIFT-1和SWIFT-2研究中,接受depemokimab治疗的患者在52周内的年化哮喘急性发作率分别显著降低了58%和48%。
慢性鼻窦炎伴鼻息肉(CRSwNP)的获批则是基于ANCHOR研究数据。结果显示,与安慰剂相比,depemokimab组患者在52周时内镜总鼻息肉评分较基线的变化,以及在49至52周期间鼻阻塞言语应答量表(VRS)平均评分相对于基线的变化,皆具有统计学显著改善。
同时在这些试验中,depemokimab耐受性良好,患者出现的副作用发生率和严重程度与接受安慰剂的患者相似。
除了英国和美国,depemokimab近期已在欧盟获得人用药品委员会(CHMP)的积极意见。在中国,该药也已提交上市申请,正在审评审批中。
此外,depemokimab正在针对其他具有潜在2型炎症的疾病进行多项3期临床试验评估,包括针对EGPA的OCEAN研究和针对HES的DESTINY研究。GSK还启动了ENDURA-1、ENDURA-2和VIGILANT 3期试验,旨在评估depemokimab作为附加疗法在未受控制的中重度COPD伴2型炎症患者中的疗效和安全性。
02
潜在重磅疗法
哮喘与慢性鼻窦炎伴鼻息肉(CRSwNP)是常见的上下气道炎症性疾病,在临床中常同时存在,相互影响,约半数的CRSwNP患者合并哮喘。
传统上,手术是CRSwNP的主要外科治疗手段,目的在于清除鼻息肉和病变组织,促进鼻窦通气引流。哮喘则主要依赖吸入性糖皮质激素和长效β₂受体激动剂。这些传统手段虽能局部控制炎症,但难以从根本上干预共通的上游炎症通路,导致上下气道炎症无法实现同步控制和长期稳定。
随着对疾病理解的深入,2型炎症通路被证实在哮喘和CRSwNP的共享遗传结构中扮演核心角色,靶向2型炎症通路的生物制剂为这类疾病带来新希望。
IL-5是2型免疫反应的核心因子,通过增加嗜酸性粒细胞的活化,参与组织损伤和炎症反应,成为2型炎症相关疾病的重要靶向治疗选择。
目前,基于该靶点已有4款生物药上市,用于治疗哮喘等嗜酸性粒细胞相关疾病,包括reslizumab、阿斯利康的benralizumab、GSK的mepolizumab和depemokimab。
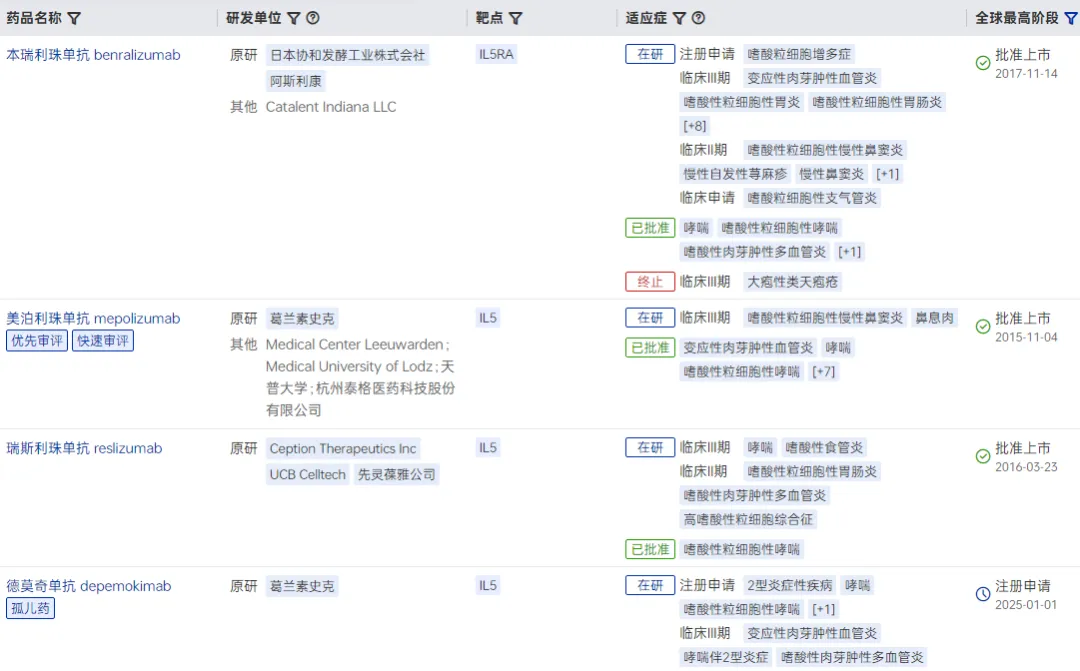
图片来源:药智数据-全球药物分析系统
GSK公司开发的Nucala(mepolizumab,美泊利珠单抗)是全球首个获批上市的IL5单抗,为每月1次制剂,最早于2015年在美国获批用于治疗重度嗜酸粒细胞性哮喘。据GSK财报,2024年美泊利珠单抗全球销售额约为22亿美元,同比增长8%。今年,Nucala又获得FDA批准,成为首个靶向嗜酸性粒细胞表型COPD的生物制剂。
在中国,美泊利珠单抗用于嗜酸性肉芽肿性多血管炎(EGPA)、重度嗜酸粒细胞性哮喘(SEA)及慢性鼻窦炎伴鼻息肉(CRSwNP)三大适应症均已成功进入国家医保目录。
但值得注意的是,Nucala在所有主要市场的专利保护已经或即将到期,未来将面临生物类似药冲击。
因此,GSK开发了新一代超长效IL5抗体——Exdensur,其更长的半衰期,支持每半年注射一次,有助于提高患者的依从性和方便性。
此次Exdensur成功获批上市,有望迭代Nucala和其他公司的IL5单抗,成为GSK的下一个潜在重磅炸弹,并巩固公司在呼吸领域的领导地位。
03
GSK在呼吸领域的多重突破
GSK作为呼吸老牌龙头药企,已建立疫苗、靶向生物制剂、吸入药物等丰富的呼吸药物管线。除了超长效IL5单抗,GSK近期在呼吸领域迎来多重喜事。
表1 GSK在呼吸领域布局
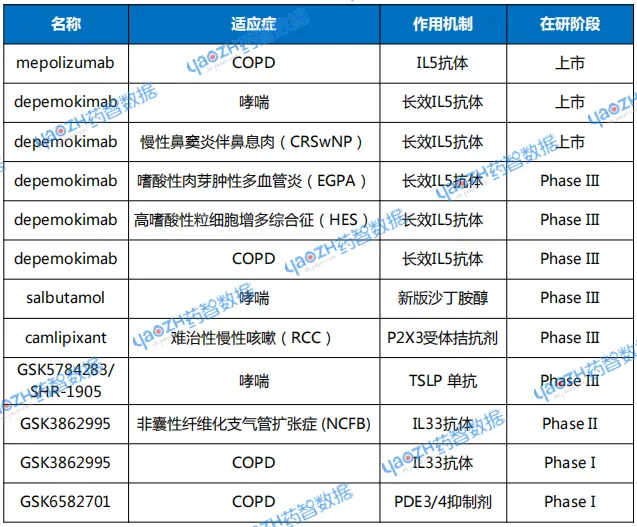
数据来源:GSK公开资料、药智数据
GSK的第一代IL5单抗Nucala在近日获得CHMP支持扩展适应症至慢性阻塞性肺疾病(COPD),用于经吸入三联疗法控制不佳的患者。
该适应症已获美国FDA批准。其MATINEE研究显示,Nucala能使COPD患者年化中重度急性加重率显著降低,与安慰剂相比,年化中重度恶化风险降低21%。
呼吸道合胞病毒(RSV)疫苗Arexvy获CHMP推荐用于所有成年人,打破此前仅针对特定老年人群的限制。这意味着该药将覆盖更广泛的易感人群,进一步巩固GSK在RSV疫苗市场的领先地位。
新一代沙丁胺醇(Ventolin)定量吸入气雾剂(MDI)的关键Ⅲ期研究已取得积极的结果。结果证实,含有创新低碳抛射剂HFA-152a的沙丁胺醇MDI与含有当前抛射剂HFA-134a的沙丁胺醇MDI在治疗效果上相当,安全性也具有可比性。
沙丁胺醇MDI用于哮喘急性发作期,可以立即治疗突然出现的呼吸症状,如呼吸困难。目前,全球每年销售约3亿支沙丁胺醇定量吸入气雾剂。GSK的新一代沙丁胺醇MDI有望减少92%的温室气体排放。公司即将提交该药的上市提交,预计2026年上市,有望为呼吸系统疾病患者带来更可持续选择的重要进展。
此外,GSK在呼吸领域还布局了多个新机制药物,包括从来源于恒瑞医药的TLSP单抗药物SHR-1905和PDE3/4抑制剂HS-9821,自研的IL33单抗GSK3862995等。
今年10月,GSK又从Empirico公司引进一款临床1期的siRNA疗法EMP-012,拟用于治疗COPD。GSK将支付8500万美元的预付款,以及最高可达6.6亿美元的潜在里程碑付款。
04
结语
Exdensur的成功获批,标志着哮喘与慢性鼻窦炎伴鼻息肉治疗进入“超长效”时代,也凸显了GSK在呼吸系统疾病领域的持续创新与战略布局。凭借其半年一次的给药频率,该药有望显著提升患者依从性与生活质量,为长期疾病管理带来革命性改变。
在IL5靶点竞争日益激烈的背景下,GSK通过给药周期的优化,成功巩固了其在呼吸领域的技术护城河。与此同时,公司通过多靶点布局以及与全球企业的合作,展现出其在全球呼吸治疗生态中的前瞻视野与整合能力。

 产业资讯
产业资讯
 药明康德
药明康德  2025-12-19
2025-12-19
 14
14
 产业资讯
产业资讯
 药智网
药智网  2025-12-19
2025-12-19
 15
15

 产业资讯
产业资讯
 高特佳投资
高特佳投资  2025-12-19
2025-12-19
 22
22