 产业资讯
产业资讯
 2016-07-06
2016-07-06
 3652
3652
来源:汤森路透 2016-7-5
如果生物类似药能够大量在美国上市,将可以节省下可观的费用。因此,美国的国会议员们指责FDA在建立生物类似药审批路径上采取循序渐进的方法,而忽视其他可能会创造或者打破新生市场的因素。
受“机会”而不是现实的驱动,大家对生物类似药节约药品开支的预期非常之高。药房福利管理公司(pharmacybenefitmanage,PBM)快捷药房(ExpressScripts)在去年初发布的2015药品趋势报告中提到,未来3年,生物类似药可能将为美国节省下将近390亿美元的药品支出,未来10年,可节省下2500亿美元。
这个数字是基于重磅炸弹级生物药专利到期的时间和生物类似药的价格比原研药低20-30%计算得出的。这个机会要得以实现,必须将生物类似药推向市场,并代替参比品使用。
除了前面提到的估算,美国国会预算办公室(CongressionalBudgetOffice)还提供了一个生物类似药潜在节省费用的更保守的估计,是10年节省下大约250亿美元,包括为联邦政府节省下60亿美元。但是同样的,这个估计的基础是生物类似药能够上市,并且相对于参比品有足够大的折扣。
在欧洲,生物类似药的价格平均比参比品低25%。而在美国,根据位于华盛顿的咨询公司AvalereHealth数据,2015年9月上市的唯一的生物类似药的标价相对于参比品只有15%的折扣。与此同时,一些专利临近到期的生物药在美国的售价持续上涨,以抵消未来的损失。
在生物类似药在美国市场上充分发挥潜力,节省下足够的费用之前,还有很多不确定因素需要解决,其中很多超出了是FDA的职权范围。从行业角度来看,医保报销是最大的未知数之一,这也是生物类似药申办方可能面对的不利因素。
合理的医保报销
Avalere的高级经理ColinShannon表示,到目前为止,生物类似药的重点还是获得监管机构的批准。但是之后,当生物类似药在美国上市后,需要认真考虑的问题就是医保报销。Shannon告诉BioWorldToday,“需要准备好一个系统,用合理的方式报销这类产品的费用”。他还补充道,政府和支付方需要制定出政策激励生物类似药的使用。这样的话,这个市场就会增长,越来越多的生物类似药将被开发出来,进一步地降低药价。
对于患者来说,一些政策可能实际上会使得生物类似药比参比品更贵。基于MedicarePartD处方药项目下的生物类似药报销结构就是一个很好的例子。
2010年出台的“合理医疗费用法案”(AffordableCareAct,ACA)同样被授权用于生物类似药,根据该法案的规定,PartD,又称“甜甜圈洞”(donuthole)计划覆盖下的患者使用生物类似药需要比使用参比品生物药自行负担更多的费用。Shannon说,“在某些层面上,这不合逻辑。”
美国联邦政府现在推出了ACA的承保缺口折扣计划(CoverageGapDiscountProgram),其目的是,在“甜甜圈洞”覆盖的保险受益人自行支付了数千美元的药费后,逐步减少他们需要自负的药品费用。该计划要求参比品的生产商向这类Medicare受益人销售药品时,提供50%的折扣。
除了降低药品在药房的售价外,在计算药品生产商所提供的药价折扣时,还需要考虑真实自负(trueout-of-pocket,TrOOP)费用。一旦患者触及TrOOP的阈值,就会进入灾难,在当年剩余时间里,他们需要自负的药价上限是5%。另外,生产商提供的药价折扣也会降低保险计划所支付的生物药费用。
该计划对于化学仿制药和生物类似药采用不同的公式。计划不需要生物类似药生产商提供零售终端的折扣,公式里包含有药物的保险计划付费和受益人付费情况。当患者的自负百分比达到了上限25%时,将会每年减少,直到2020年。这个TrOOP费用将只有患者实际上自己支付的费用。
Shannon指出,虽然目前正在开发中的生物类似药绝大多数的参比品都是PartB计划所覆盖的,但是因为不同的医生处方,所以报销比例不同。美国最畅销的生物药——修美乐(阿达木单抗,艾伯维)和恩利(依那西普,安进)是属于PartD计划。FDA已经接受了上述两个药物的生物类似药申请,其中有一个是安进公司开发的修美乐生物类似药。(见BioWorldToday,2016年4月26日)
如果安进的这个生物类似药在2017年上市,那么“甜甜圈洞”里的Medicare患者将不得不支付这个药物51%的费用,这将被计入当年他们的TrOOP费用,而PartD计划将负担剩余的49%。(见下表)
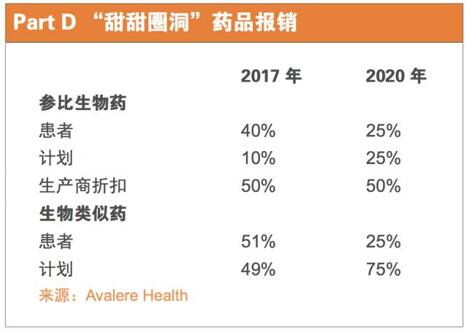
而如果患者使用了修美乐,他们只需要支付40%的费用,艾伯维公司将提供50%的药价折扣,PartD计划负担剩下的10%。此外,生物药费用的90%将被计算到患者的TrOOP里,这意味着,在这种情况下,患者将更快逃离“甜甜圈洞”这个坑。
即使是到2020年,届时折扣计划已经完全分阶段执行,PartD“甜甜圈洞”的患者可能会不再使用参比品,这取决于生物类似药提供的折扣。不论患者是选择参比生物药,还是生物类似药,他们都将负担药品成本的25%。但是,如果他们使用参比生物药,生产上提供的50%折扣也将计入到他们的TrOOP里。
鉴于2020年PartD计划为参比品和生物类似药付费的不同——参比品10%,生物类似药75%,除非生物类似药公司提供一个真正划算的好交易,这个计划可能会引导患者使用参比品。
阻碍更便宜的生物药推向市场
Shannon说,随着越来越多的PartD生物药上市,“随着时间推移,这个问题将越来越严重”,这将会破坏将更便宜的药品推向市场的目标。他补充说,由于这个问题牵涉到法律,所以解决它需要国会采取行动。
Shannon说,虽然目前生物类似药“肯定多数会参加PartB计划”,但是这种不平等会阻碍生物类似药的开发。因为PartB所覆盖的生物药是医生处方的,所以这部分生物药的报销比例是根据“美国医疗保险和医疗补助中心”(CentersforMedicare&MedicaidServices,CMS)制定的医生处方收费表(physicianfeeschedule)来决定的。也就是说,是由政策制定者,而不是法律确定的。
尽管美国FDA和国会尖锐地指出,生物类似药不是化学仿制药,但是2016年生物类似药首次进入收费表后,CMS坚持对这类药物采用与化学仿制药相同的报销方式。这个和收费表为每个参比的生物药设置了一个付费代码,而相对于这个参比品的所有生物类似药都混在一起给予另一个代码。(见BioWorldToday,2015年7月21日和2015年11月3日)
Pfenex的CEOBertLiang告诉BioWorldToday,Medicare基于有着同样付费代码的所有生物类似药的平均销售价格和市场份额来确定付费。对于申请方来说,要获得更多的付费,就要获得更大的市场份额。这些公司极有可能通过提供低价来获得市场份额,这就导致了“竞相杀价”。
在那种情况下,很多制药公司就会发现,专注于开发创新药物比生物类似药利润更加丰厚。Liang说道,“这对于一些生物类似药的开发商来说将是一个挑战”。Liang同时也是仿制药协会(GenericPharmaceuticalAssociation)生物类似药委员会的主席。
“影子监管机构”
霍金路伟律师事务所(HoganLovellsLLP)的合作人DavidFox告诉BioWorldToday,生物类似药的报销并不只是CMS的问题。所有的支付方,尤其是PBM,都因为影响到药物在市场上的使用而成为“影子监管机构”。它们的政策可能创造也可能打破这个新兴的市场,这取决于它们如何制定政策。
PBM与药房签署合同,执行MedicarePartD计划,与制药公司协商出实际的药品价格(与公开的“标价”不同),并决定哪些药品进入支付方的处方集,以及这些药物归属于哪个付费方案。
目前在美国,3家PBM占据了将近80%的市场。这3家PBM所行使的权力与任何一家监管机构一样大,通常情况下,通过它们获得的处方比来自医生的更多。因此,它们决定了患者获得的药品,以及患者为药品自己承担的费用。简单来说,它们将成为生物类似药的市场看守者。
——BioWorldToday,2016年4月28日

 产业资讯
产业资讯
 财经大健康
财经大健康  2025-11-04
2025-11-04
 39
39

 产业资讯
产业资讯
 深蓝观
深蓝观  2025-11-04
2025-11-04
 38
38

 产业资讯
产业资讯
 BiG生物创新社
BiG生物创新社  2025-11-04
2025-11-04
 31
31