 产业资讯
产业资讯
 药智数据
药智数据  2026-02-03
2026-02-03
 9
9
01
2025年度全球新药研发进展概览
1.1进展到最新阶段的项目
2025年,包括创新药、改良型新药、生物类似物在内的,研发阶段从临床申请到批准上市阶段,全球范围内共有4788个新药项目推进到最新的阶段(首次获批进入下个新阶段),其中在中国境内进行的项目共2459个,境外项目有2329个。其中创新药占84%,改良型新药占13%,生物类似物占3%。具体研发阶段药品内容可通过药智数据【全球药物分析系统】进行查看。
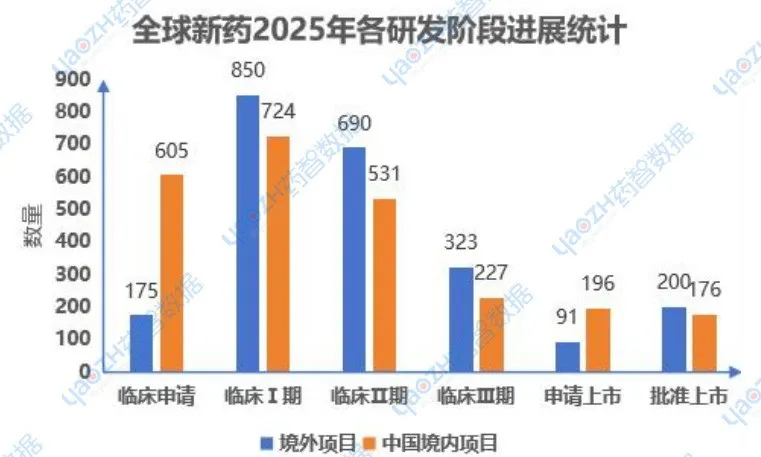
数据来源:药智数据-全球药物分析系统
1.2靶点研发进展
2025年,在新药研发靶点板块,由于自免领域存在热的发烫的减肥适应症,毋庸置疑GLP-1R成为最热靶点。与此同时,CD19、CD3和PD-1等靶点在临床I期和II期也展现出较为积极的研发态势,预示着免疫治疗和细胞治疗领域仍是当前的研究热点。以下是2025年度新药研发排名前十的靶点,图中仅展示药品总数,具体靶点详情内容可通过药智数据【全球药物分析系统】进行查看。
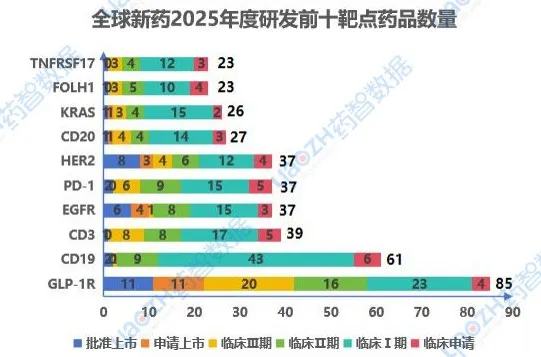
数据来源:药智数据-全球药物分析系统
1.3进展到最新阶段的项目
2025年,从治疗领域来说,肿瘤和罕见病领域依然是药物研发的重点,尤其在临床试验阶段。免疫相关疾病和胃肠道疾病的研发也在不断增长,反映了对精准治疗和免疫疗法的关注。尽管内分泌和泌尿生殖系统疾病的研发相对较少,整体来看,随着全球健康需求变化,药物研发正向新兴领域扩展,未来治疗前景广阔。以下是2025年度排名前十的治疗领域排名,图中仅展示药品总数,具体适应症内容可通过药智数据【全球药物分析系统】进行查看。
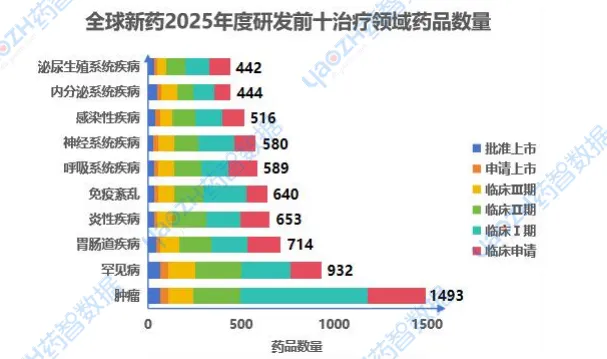
数据来源:药智数据-全球药物分析系统
1.4药品类别研发进展
2025年,从药品类别分析,药物研发正向多元化发展,化药仍为主流,但细胞疗法、单克隆抗体和疫苗等生物治疗快速发展,尤其在抗癌和免疫治疗领域。基因疗法、ADC和核酸(今年小核酸药物研发最热)等前沿技术逐步成熟,未来治疗将更加精准和个性化,推动疾病治疗进入新阶段。 以下是2025年度新药研发排名前十的药品类别,图中仅展示药品总数,具体药品类别内容可通过药智数据【全球药物分析系统】进行查看。
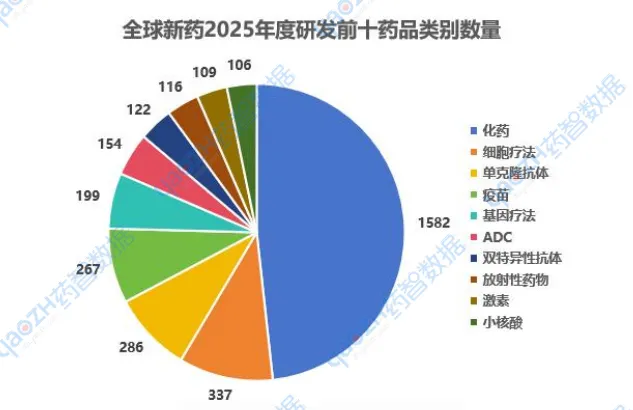
数据来源:药智数据-全球药物分析系统
1.5企业研发进展
2025年,从研发企业分析,制药行业加速推进药物研发,阿斯利康和恒瑞医药等公司在临床III期表现活跃,显示出较强的研发成熟度。礼来和齐鲁制药等则专注早期研发,持续创新。随着对创新药物需求增长,未来将有更多新药问世,推动精准治疗和免疫治疗的发展。国内仅齐鲁和恒瑞挤进研发前十,剩下的都是国际大公司,中国创新药研发需加快追赶脚步。以下是2025年度前十研发企业新药研发排名,图中仅展示药品总数,具体企业研发内容可通过药智数据【全球药物分析系统】进行查看。
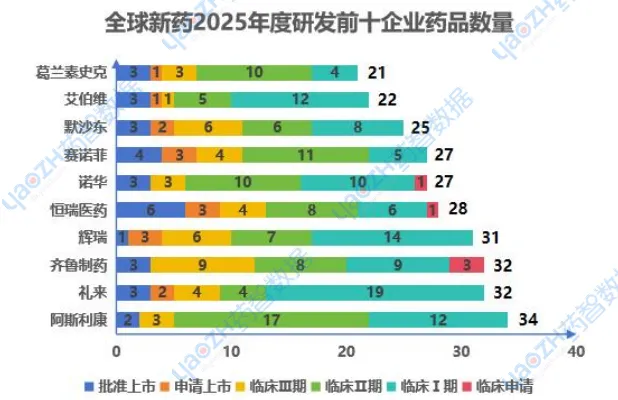
数据来源:药智数据-全球药物分析系统
02
2025年度全球新药各阶段重点项目
2.1全球获批的新药
据全球药物分析系统数据库统计,2025年全球共285款新药首次获批上市,包括157个创新药、81个改良型新药和47个生物类似药。从创新药的角度分析,境外共90个药品首次获批上市,包括美国、欧盟、日本等境外地区,在中国境内共有134个药品首次获批。
2.1.1 中国NMPA获批创新药进展
2025年,国家药品监督管理局(NMPA)累计批准了134款创新药(首次在国内上市的药品,不包括同个药物的新适应症和新剂型)。其中共有78款化药、50款生物药,6款中药,具体药品信息详见文末药品上市清单附表。在这些创新药中,化药由于其分子量小,相对研发难度小,占据半壁江山,高达57%,其次是单克隆抗体,除此之外,还包括了其他类型药物包括疫苗、激素、ADC药物、基因疗法、细胞疗法、小核酸等。
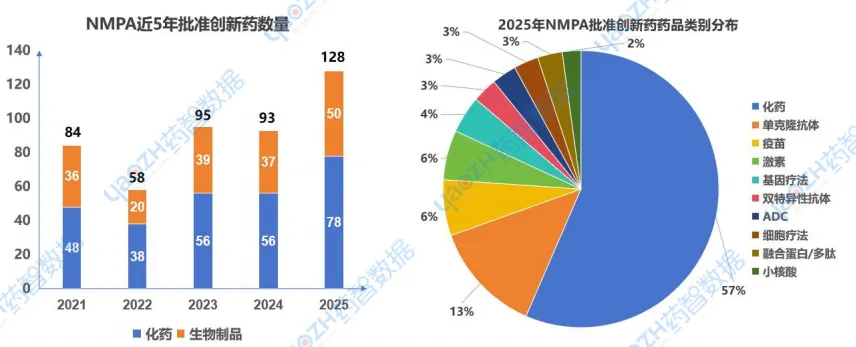
数据来源:药智数据-全球药物分析系统
就中国获批上市新药特殊审评类型来看,有38个药物获中国优先审评途径上市、25个药物获中国特殊审评、还有19个药物被认定为突破性治疗,以及18个药物通过附条件批准上市。
从上市治疗领域来看,肿瘤仍然是对人们健康威胁最大的疾病,共有43款药物获批,在此之后呼吸系统疾病和内分泌疾病的研发活跃度也较高,分别有27款和24款药物获批;其他领域包括免疫紊乱、感染疾病、炎性疾病、血液系统疾病等,也都有不同品类的创新药获批上市。
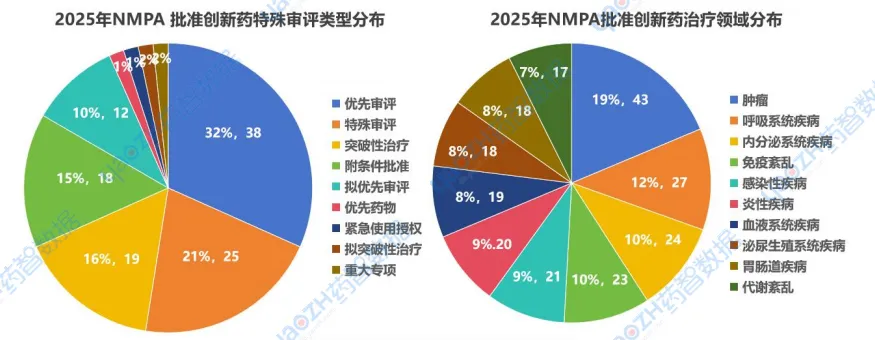
数据来源:药智数据-全球药物分析系统
2025年,多款药物在中国的成功上市同样也创下“首个”的获批纪录,为国内患者临床用药的可及性提供了更多选择:
1、艾米迈托赛:2025年1月2日,铂生卓越生物的干细胞疗法艾米迈托赛(amimestrocel/睿铂生)在中国获批上市,用于治疗14岁以上消化道受累为主的激素治疗失败的急性移植物抗宿主病。这是国内首款获批上市的干细胞疗法,填补了国内干细胞治疗的空白。
2、瑞卡西单抗:2025年1月10日,恒瑞医药的注射用瑞卡西单抗(Recaticimab/艾心安)在中国获批上市,适用于治疗高胆固醇血症和混合型血脂异常。瑞卡西单抗突破了目前国内外已获批的PCSK9单抗需要每2周、4周或6周的注射频次,是全球首个超长效PCSK9单抗。
3、盐酸替那帕诺:2025年2月20日,复星医药的盐酸替那帕诺片(Tenapanor hydrochloride/万缇乐)在中国获批上市,用于控制正在接受血液透析治疗的慢性肾脏病(CKD)成人患者的高磷血症。替那帕诺作为全球首个且目前唯一获批的磷吸收抑制剂,开启了多种机制协同降磷的新时代,为中国透析高磷血症患者带来新的希望。
4、佳达修9:2025年4月14日,默沙东的佳达修9(九价人乳头瘤病毒疫苗)在中国获批上市,适用于16~26岁男性接种,可预防HPV感染引起的肛门癌、生殖器疣(尖锐湿疣)、肛门上皮内瘤样病变。成为国内首个且目前唯一可供适龄男性和女性接种的九价HPV疫苗。这一突破标志着中国正式进入“男女共防HPV相关癌症及疾病”的新阶段。
5、卡匹色替:2025年4月15日,阿斯利康的卡匹色替片(Capivasertib/荃科得)在中国获批上市,适用于局部晚期或转移性乳腺癌成人患者。卡匹色替片是国内首个获批上市的AKT抑制剂,阿斯利康的乳腺癌治疗版图进一步扩大。
6、维拉苷酶β:2025年5月13日,北海康成的注射用维拉苷酶β(velaglucerase beta/戈芮宁)在中国获批上市,用于治疗12岁及以上青少年和成人Ⅰ型和Ⅲ型戈谢病患者。维拉苷酶β是中国首个,也是目前唯一本土自主开发的用于治疗戈谢病的药物,打破了进口药物的垄断局面,填补了国内自主研发的空白。
7、盐酸阿思尼布:2025年5月13日,诺华的盐酸阿思尼布(asciminib hydrochloride/信倍立)在中国获批上市,用于治疗新诊断的费城染色体阳性的慢性髓细胞白血病慢性期成人患者。阿思尼布成为全球首个且目前唯一获批基于ABL肉豆蔻酰口袋(STAMP)创新机制的靶向药物,开启慢粒STAMP精准靶向治疗新时代,也为国内慢性髓细胞白血病患者提供了全新治疗选择。
8、玛仕度肽:2025年6月27日,信达生物与礼来合作研发的玛仕度肽注射剂(信尔美/mazdutide/IBI362)在中国获批上市,用于成人肥胖或超重患者的长期体重控制。玛仕度肽是全球首个GCG/GLP-1双受体激动减重药物,被评为2025全球十大最受期待药物之一,有望打破司美格鲁肽、替尔泊肽在减重药领域双雄争霸的格局。
9、马塔西单抗:2025年11月18日,辉瑞的马塔西单抗(marstacimab/友瑞宁)在中国获批上市,用于12岁及以上不伴抑制物的重型血友病A或B患者常规预防。这是中国首个获批的抗TFPI单克隆抗体,也是全球范围内最便利的血友病预防方案——每周一次固定剂量皮下注射。
10、库莫西利:2025年12月9日,正大天晴的库莫西利胶囊(culmerciclib/赛坦欣)中国获批上市,联合氟维司群,用于既往接受内分泌经治的激素受体阳性、人表皮生长因子受体2阴性的(HR+/HER2-)局部晚期或转移性乳腺癌患者。库莫西利是全球首个CDK2/4/6抑制剂,对于临床上CDK4/6抑制剂耐药、减轻骨髓抑制问题,提供了全新的治疗方案。
2.1.2 美国FDA获批新药进展
2025年,美国FDA药物评价与研究中心(CDER)共批准了46款新药,包括34个化药和12个生物药,虽较去年50款有所下降,但仍高于历史平均水平且"first-in-class"药物占比近半,共有20个药物占比43%,彰显了审批对创新质量的聚焦。2025 年,FDA经历了前所未有的内部变动。人员层面动荡显著以及政策框架同步迎来变革,但它清晰地展示了在不稳定环境中,生物医药创新并未停滞。新药开发持续从肿瘤向更广泛疾病领域拓展,基因治疗走向多元化,监管体系本身也在积极适应科学进步。
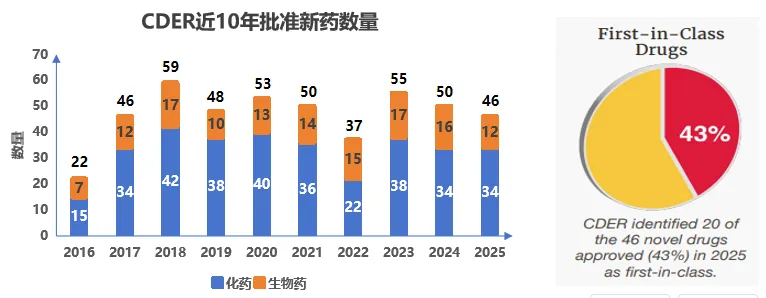
数据来源:FDA官网、药智网整理
从审评流程看,除了常规特殊审评以外,2025年新增国家优先审评券(CNPV)计划,旨在将审评时间从通常的10-12个月缩短至2个月;FDA还针对随机试验不可行的情况提出了"合理机制通路"。此外,它宣布计划逐步取消动物毒性试验。在2025年,有18个药物(45%)被授予为快速通道资格、15个(33%)被认定为突破性治疗药物,21个(46%)被认定为优先审评,11个(24%)获得加速审批。
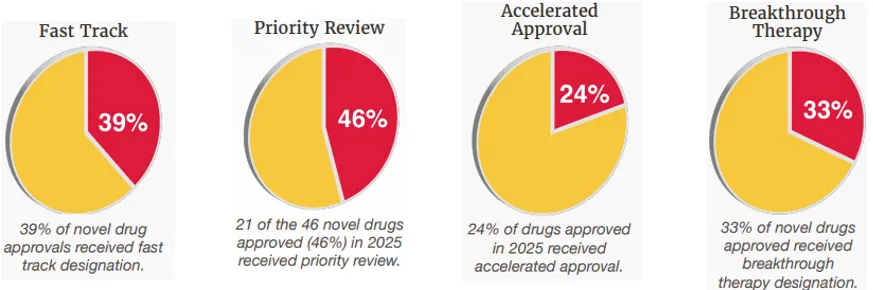
2025年FDA获批新药特殊审评占比(图片来源:FDA官网)
从治疗领域来看,肿瘤领域依然是最热门的赛道,全年共有16款抗肿瘤药物获批,占比高达35%,高于过去五年的平均水平。这些药物涵盖了肺癌、乳腺癌、卵巢癌、血液瘤等多种类型。心脏病学(5款,占11%)、过敏与炎症性疾病(4款,占9%)紧随其后,构成了非肿瘤领域的核心创新阵地。
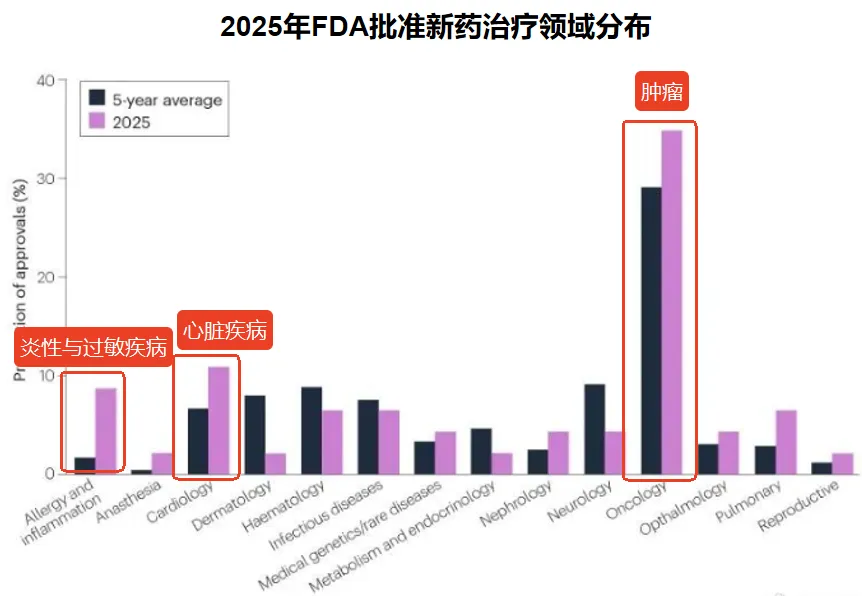
2025年FDA获批的新药中有多款为潜在重磅疗法,其中值得关注的重点药物有:
1、Journavx(Suzetrigine):2025年1月30日,FDA批准Vertex公司的Suzetrigine上市,用于治疗成人中度至重度急性疼痛。Suzetrigine是一种新型非阿片类镇痛药,是全球首款获批上市的治疗疼痛的 NaV1.8抑制剂,是美国FDA所批准的首款基于新机制的非阿片类止痛药物,该药物的获批将使之成为20多年来首个用于治疗急性疼痛的新机制药物。
2、Ekterly(Sebetralstat):2025年7月3日,FDA批准KalVista公司的Sebetralstat上市,用于治疗≥12岁患者的遗传性血管性水肿(HAE)急性发作,是全球首个HAE急性发作口服疗法,有望显著改变该疾病的治疗格局。
3、Brinsupri(Brensocatib):2025年8月12日,FDA批准Insmed公司的brensocatib上市,用于治疗成人和12岁及以上儿童的非囊性纤维化支气管扩张症(NCFB)。Brensocatib是全球首个获批上市的二肽基肽酶1(DPP-1)抑制剂,同时也是FDA批准首个用于治疗NCFB的药物。
4、Forzinity(Elamipretide):2025年9月19日,FDA批准Stealth BioTherapeutics公司的elamipretide注射剂,用于体重至少30 kg的Barth综合征(Barth syndrome)患者,成为了全球首个用于治疗Barth综合征的药物,标志着罕见病治疗领域又一项重要进展。
5、KYGEVVI(Doxecitine/Doxribtimine):2025年11月3日,FDA批准UCB公司的KYGEVVI上市,用于治疗症状起始年龄≤12岁的成人和儿童胸苷激酶2缺乏症(TK2d)患者,是全球首款且唯一获批的TK2d针对性治疗药物。
2.2全球申请上市的新药
2025年全球共287款新药申请上市,其中境外共有91款新药申请上市,国内有196款新药申请上市。下表展示2025年处于申请上市阶段的部分重磅新药,完整信息可通过药智数据【全球药物分析系统】查看。
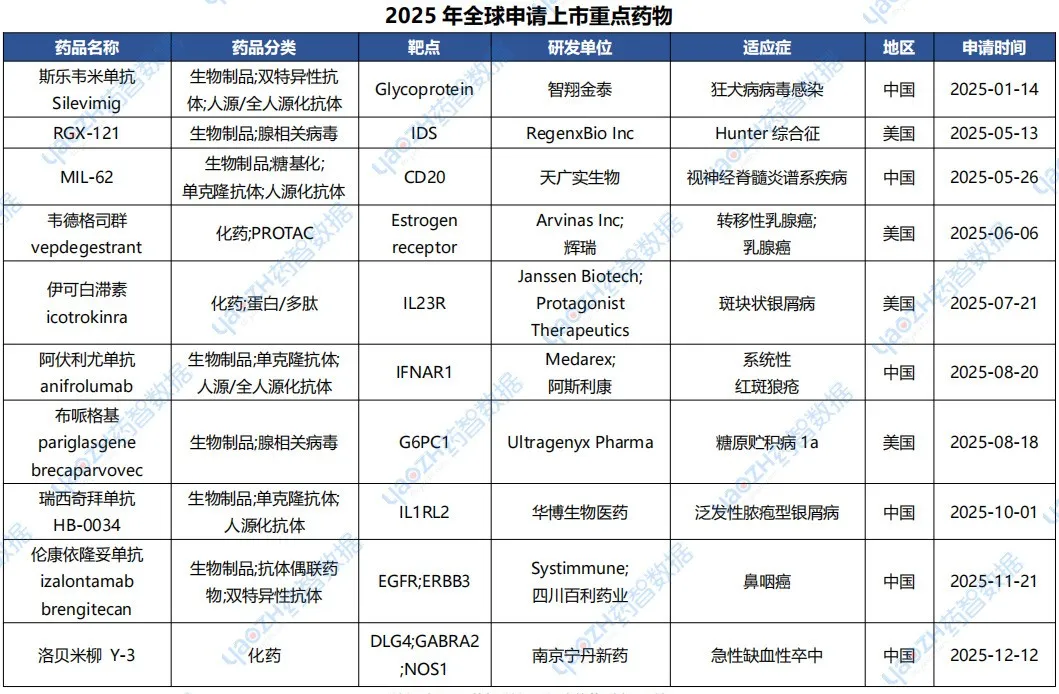
数据来源:药智数据-全球药物分析系统
2.2.1 Vepdegestrant——全球首例PROTAC靶向降解药物FDA申报上市
2025年6月6日,Arvinas宣布,已与合作伙伴辉瑞共同向美国FDA提交了Vepdegestrant(ARV-471,PF-07850327)的新药上市申请,用于治疗携带ESR1突变的ER+/HER2-晚期或转移性乳腺癌患者。经过24年科学探索,PROTAC技术终于迈出从实验室到商业化的关键一步,这是全球首个申报上市的PROTAC药物,标志着靶向蛋白降解技术从概念验证走向临床应用的重大突破。
据药智数据【全球药物分析系统】统计,目前共有264个PROTAC新药处于研发阶段,35款已步入临床,占比13.3%。其中,Arvinas的Vepdegestrant作为唯一处于新药上市申请阶段的产品,肩负着验证PROTAC市场价值的重任,同时,在未来的时间,靶向蛋白降解领域或将迎来爆发式增长。
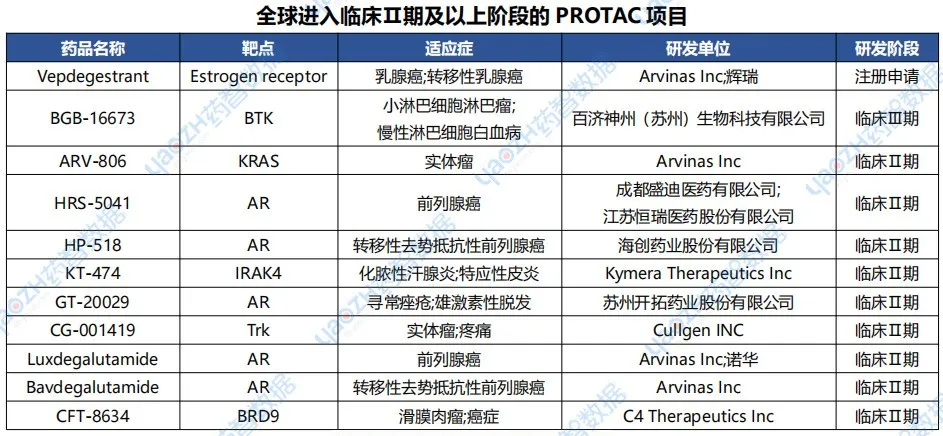
数据来源:药智数据-全球药物分析系统
2.2.2 Icotrokinra——全球首款IL-23靶向药物FDA申报上市
2025年7月21日,强生宣布,已向FDA提交icotrokinra的新药上市申请,用于治疗12岁及以上成人和儿童中度至重度斑块性银屑病,是全球首款靶向IL-23的口服肽药物,可选择性阻断IL-23受体。2021年,强生以9.8亿美元的价格与Protagonist达成协议,获得其全球权益。如果成功获批,icotrokinra将成为全球首个也是唯一一个靶向IL-23的药物。
2.2.3 伦康依隆妥单抗——全球首款EGFR/HER3双抗ADC国内申报上市
2025年11月21日,CDE官网显示,百利天恒EGFR/HER3双靶点ADC药物伦康依隆妥单抗(BL-B01D1)上市申请获受理,用于鼻咽癌的治疗,BL-B01D1是全球唯一一款HER3/EGFR双抗ADC药。早在2023年12月,百利天恒与百时美施贵宝就BL-B01D1的开发和商业化达成了合作,百利天恒保留中国大陆的独家权益,而百时美施贵宝将获得在全球其他市场的独家许可,总交易额高达84亿美元的,首付款就达到了8亿美元,无论是总金额还是首付款,都刷新了国产ADC新药授权出海纪录。
国产创新药的正逐渐加快研发的脚步走出临床,准备上市,据药智数据【药品注册与受理】数据库统计,2025年有62款国产创新药(不包括改良新、中药、生物类似药),共91个品种正处于CDE审评审批。其中,有68个品种处于新报任务审评中,占比达到3/4、6个品种已完成新报审评、17个品种处于补充任务审评中。
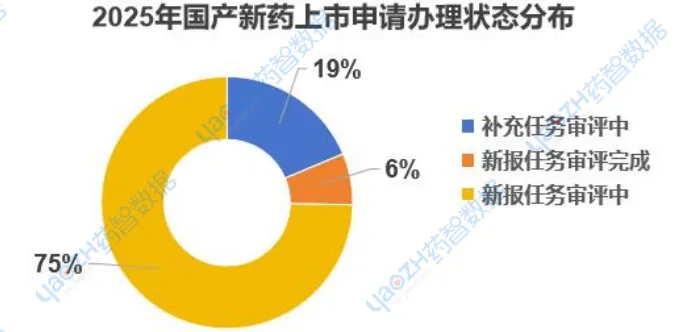
数据来源:药智数据-药品注册与受理
根据“药智预测”的情况来看,大多数处于补充任务阶段的品种以及部分优先审评的新报任务品种均有望在2026年获批。下表将展示2025年在中国处于申请上市阶段且在2026年有望批准上市的重磅国产创新药,更多药品信息可通过药智数据【全球药物分析系统】查看。
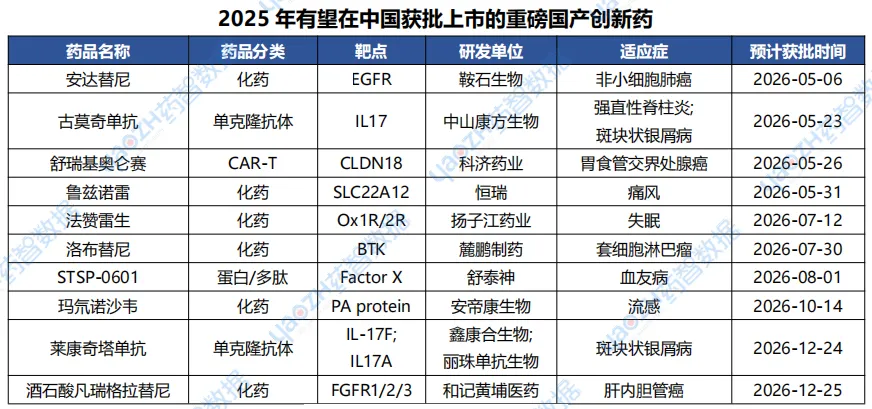
数据来源:药智数据-药品注册与受理
2.3全球新药临床项目进展
2025年有超过4000款新药在临床阶段推进到最新的阶段(首次获批进入下个新阶段),其中在境外进行的临床有2038款,在中国境内有2087款临床在研药物,临床Ⅰ期以1574款药物占比最多达到38%,临床Ⅲ期由于是临床最关键的阶段,是最终为药物注册申请的审查提供充分的依据的阶段,失败率通常较高,能进入到该阶段的药物较少,只有550款药物,只占13%。
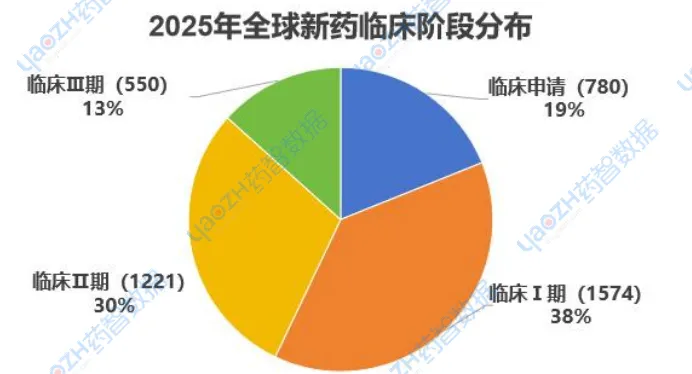
数据来源:药智数据-全球药物分析系统
以企业研发角度来看,2025年,中国与国外药企的临床项目数据对比,国内药企在临床研发的数量和进展方面仍存在一定差距。中国企业如齐鲁制药和恒瑞医药在三期和二期临床项目上表现突出,其余企业大部分项目集中在早期阶段。与此相比,国外药企如阿斯利康、辉瑞、赛诺菲等在临床研发的各个阶段都有显著布局,表明这些公司不仅在现有药物的推进上具备强大实力,还在开发多个新药候选项目。这种差异表明,国内企业在临床研发方面虽然取得了一定成就,但在创新药的多样化开发、早期研发的深度以及全球化布局方面仍需进一步加大投入,缩小与国际领先企业的差距。
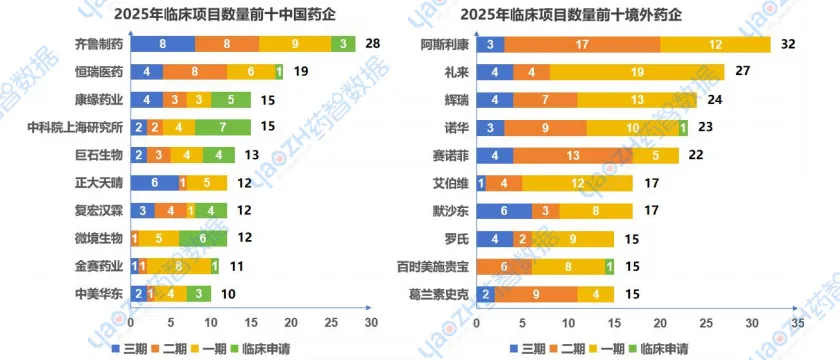
数据来源:药智数据-全球药物分析系统
以药品类别来看,化学药物仍占主导地位,但细胞疗法、疫苗、单克隆抗体等生物药物的研发迅速增长,特别是在肿瘤和免疫疾病治疗中。基因疗法和ADC等精准治疗技术也在推进中。小核酸、PROTAC和溶瘤病毒等前沿技术虽处于初期阶段,但具有显著潜力,预示着未来治疗的新突破;以治疗领域来看,肿瘤依然是研发重点,反映精准和免疫治疗的快速发展。罕见病和免疫紊乱的研究持续增长,凸显对特殊疾病的关注。胃肠道疾病、神经系统疾病和感染性疾病也保持高研发活跃度,尤其是疫情后感染疾病研究的加速。整体来看,精准医疗和创新治疗将继续推动未来的药物研发。
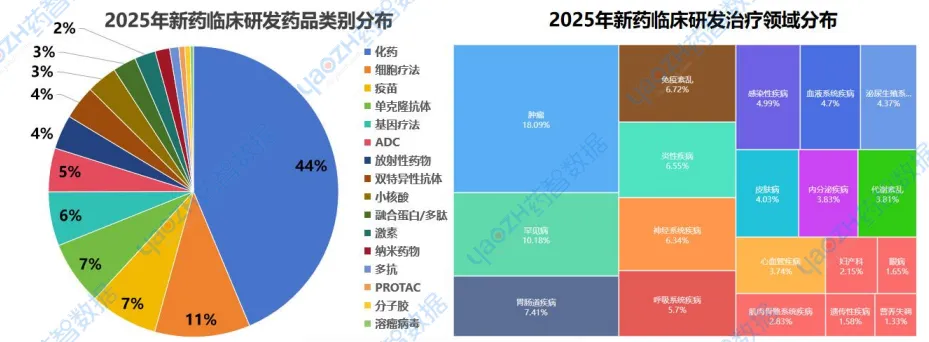
数据来源:药智数据-全球药物分析系统
下表将展示在2025年全球进入重点临床试验的热门药物的相关信息,更多完整信息可通过药智数据【全球药物分析系统】进行查看。
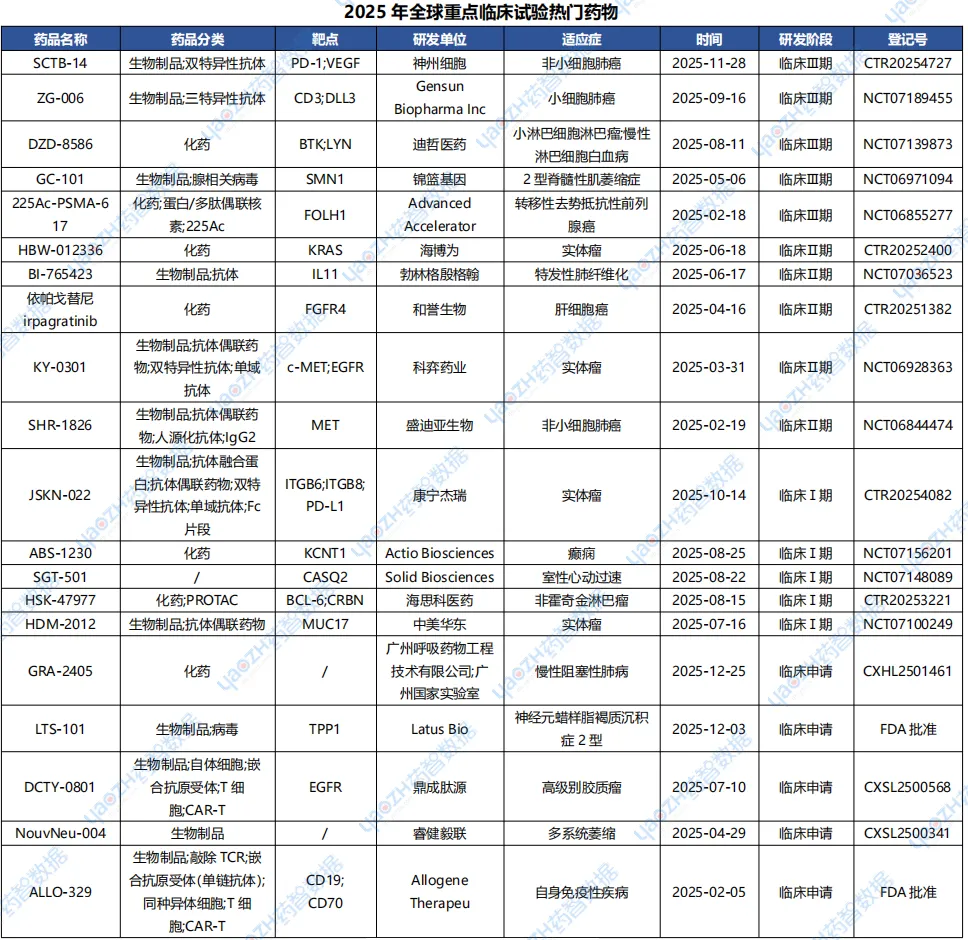
数据来源:药智数据-全球药物分析系统
2.3.1 GC-101——国产首款脊髓性肌萎缩症基因疗法中美同期进入Ⅲ期临床
2025年5月6日,北京锦篮基因科技有限公司的GC-101腺相关病毒注射液在美国FDA启动的三期临床试验(NCT06971094),在10天后的5月16日,锦篮基因在中国同样登记启动一项三期临床试验(CTR20251902),均是用于治疗2型脊髓性肌萎缩症(SMA)。GC-101是首个针对脊髓性肌萎缩症适应症进入三期临床的国产药物。
据全球药物分析系统数据库统计,目前已有4款治疗脊髓性肌萎缩症的药品获批上市,但都是海外产品,包括罗氏的risdiplam、诺华的onasemnogene abeparvovec、渤健的nusinersen sodium以及武田的leuprorelin acetate,其中三款已在中国上市。国内企业目前只有锦篮基因的GC-101处于第一梯队,进入临床三期,还有包括蓝图生物、嘉因生物、金珂博生物等也有相关项目进入临床研发阶段。如果临床顺利,GC-101有望成为国产首款治疗脊髓性肌萎缩症的药物,为广大患者带来新选择。
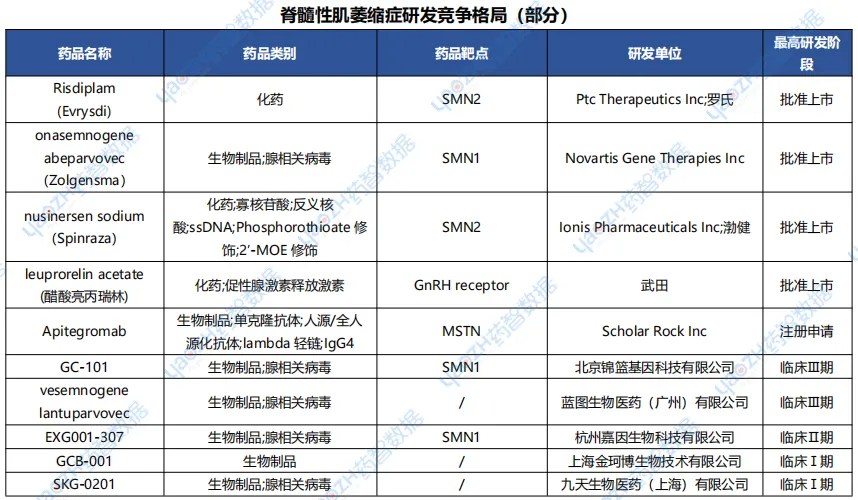
数据来源:药智数据-全球药物分析系统
2.3.2 HBW-012336——国内首款口服KRAS G12D抑制剂到达Ⅱ期临床
2025年6月18日,海博为药业自主研发的高活性、高选择性、高组织靶向性、口服KRAS G12D抑制剂HBW-012336在中国进入临床Ⅱ期,标志着海博为药业KRAS研发管线取得又一里程碑式进展。该药拟用于多种携带KRAS G12D突变的肿瘤治疗,一举突破口服生物利用度低、剂型限制等国际性难题。
KRAS蛋白因其特殊的光滑圆球结构和对底物GTP的超强亲和力等原因,曾有“不可成药”靶点之称,开发难度极大。尽管如此,人们对KRAS G12D抑制剂的研究热度依旧持续攀升,业内预计,KRAS G12D抑制剂的潜在市场将超百亿美元。目前,据全球药物分析系统数据库统计,全球共有108个KRAS G12D抑制剂项目,但尚无KRAS G12D抑制剂获批上市,进展最快的包括恒瑞的HRS-4642、劲方医药的GFH375、Revolution Medicines公司的Daraxonrasib,处于三期临床,其余大多数基本处于Ⅰ/Ⅱ期临床研究阶段,比如阿斯利康的AZD-0022、泰励生物的TSN-1611、科睿药业的DN-022150等均处于该阶段,其余均处于临床早期研究阶段。
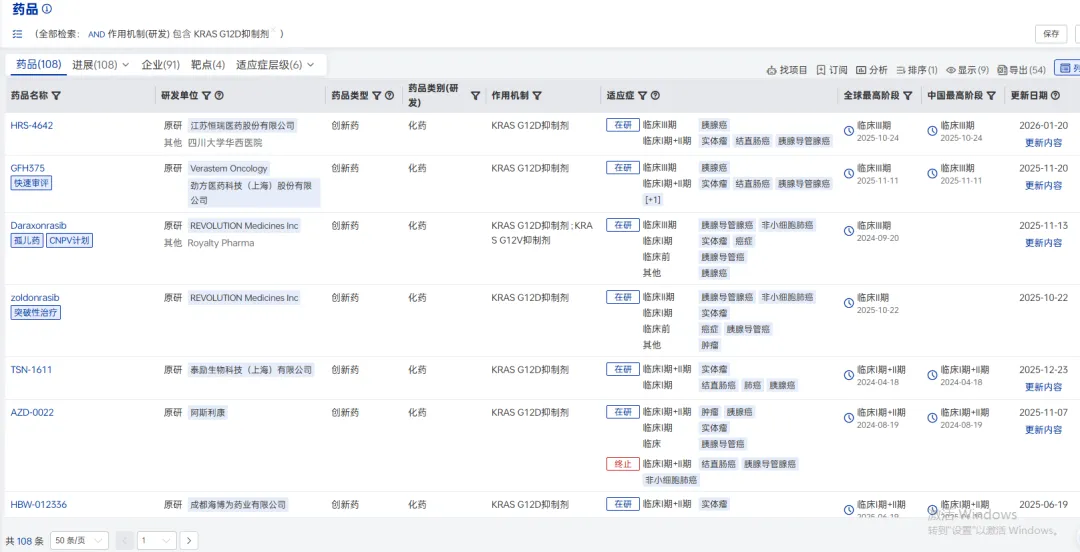
KRAS G12D抑制剂市场竞争格局(图片来源:药智数据-全球药物分析系统)
2.3.3 HSK-47977——国产首款BCL-6药物进入Ⅰ期临床
2025年8月15日,海思科医药自主研发靶向BCL6的 PROTAC药物HSK47977进入Ⅰ期临床,拟用于非霍奇金淋巴瘤的治疗。目前,全球同靶点药物暂无临床数据公布,国内也尚无同靶点药物进入临床阶段。HSK47977领跑国内赛道,有望成为国产首个BCL-6药物。
据全球药物分析系统数据库统计,目前全球范围内共有35款BCL6靶向药物在研,但仅有6款进入临床并也只均处于临床早期,其中百时美的BMS-986458研发进度最快,到达临床Ⅱ期,其余项目均在临床Ⅰ期,国内更是仅仅只有海思科进入临床研究阶段。
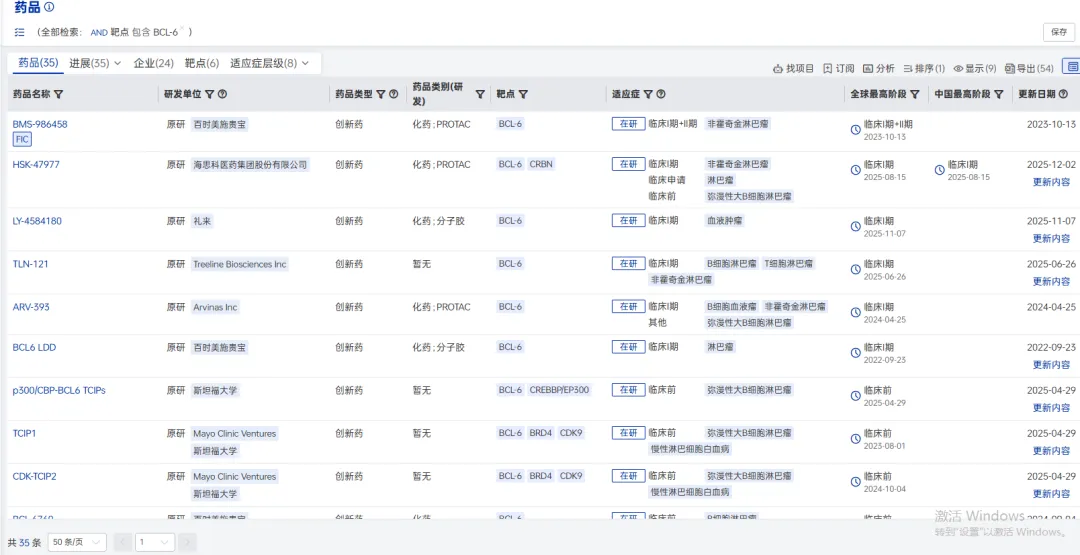
BCL6靶向药物在研格局(图片来源:药智数据-全球药物分析系统)
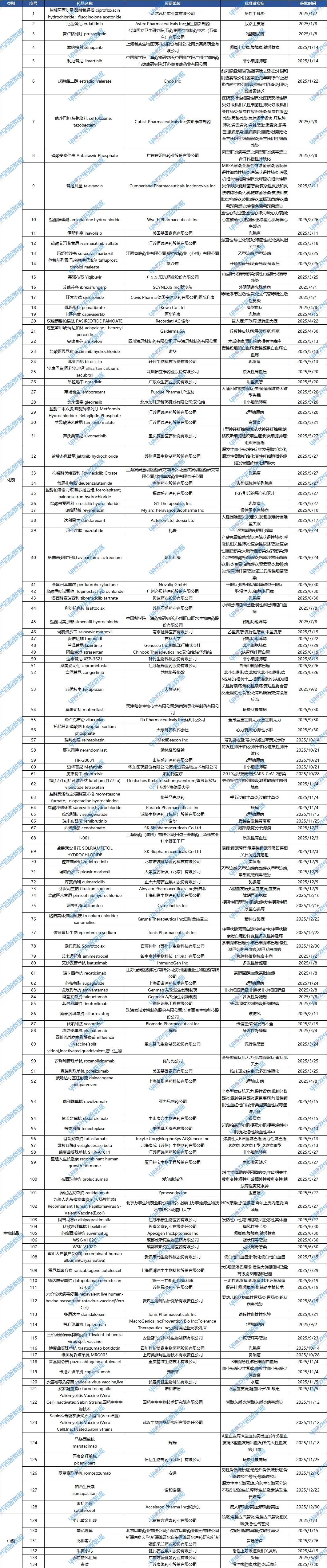
附表:2025年中国批准上市的创新药
附:《2025年度全球新药研发进展报告》目录


 产业资讯
产业资讯
 药智数据
药智数据  2026-02-03
2026-02-03
 9
9

 产业资讯
产业资讯
 医药魔方
医药魔方  2026-02-03
2026-02-03
 11
11

 产业资讯
产业资讯
 财经大健康
财经大健康  2026-02-03
2026-02-03
 10
10