 产业资讯
产业资讯
 2015-12-17
2015-12-17
 3198
3198
来源:识林 2015-12-17
FDA近日公布药品审评和研究中心(CDER)新药办公室主任John Jenkins关于2015年新药审评更新的幻灯片。处方药生产商付费法案(PDUFA) V 新分子实体(NME)计划获得广泛成功。突破性治疗认定/批准持续增长。优先审评券(PRV)获得持续关注,美国审计总署(GAO)对罕见儿科优先审评券项目的研究正在进行。NME首轮获批率保持历史性高位。美国批准的新分子实体药品继续领跑全球,2014年在美国首次推出的新活性成分占世界总量的60%。生物类似药项目持续增长。尽管成绩斐然,但巨大挑战依旧,不断增长的工作量给项目资源带来的压力,招聘和留住工作人员仍是一项重大挑战。
在完成PDUFA规定的目标方面,FDA继续完成或超越该法案规定的几乎所有申请审评目标。FDA新药办公室在编人员维持小幅增长,2013财年初为916位全职雇员,2016财年初增加到1014位,但仍低于目前授权限额1067位全职雇员。
新药审评方面,截止2015年12月9日,CDER受理36件NME申请,批准41个NME,包括19个孤儿药,再次突破1983年《罕见病用药法案》开始实施以来的记录(去年为17个)。首轮获批率(意味着无需要求可能拖延批准或导致另外一轮审评的额外信息)保持历史性高位(88%),中位审评时间略有上涨,因为NME计划60天的备案审查是在PDUFA目标日期之外计算的,没有开启审评时钟。
2014-2015财年PDUFA V审评绩效 (截至2015年9月30日的数据)
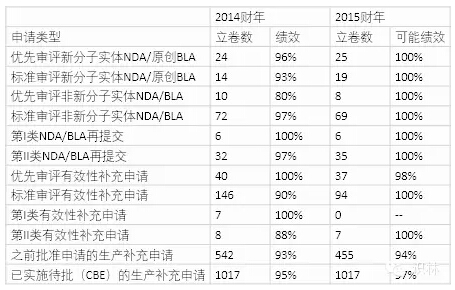
一个相当惊人的信息是2015财年的首次行动获批率。报告中,新药申请(NDA)和生物制品许可申请(BLA)的整体首次行动获批率为95%,优先审评NDA/BLA申请的首次行动获批率为93%,标准NDA/BLA的首次行动获批率为100%。这是令人难以置信的工作。
这里引出的问题是,FDA是未经审查即批准NDA/BLA吗?Jenkin博士给出了否定的答案,并提供了首次行动获批率如此之高的原因,他指出:
· CDER没有改变其对于批准法定标准的解释 – 我们不是一个“橡皮图章”(只盖章不审查内容)
· 可能的因素有:
§ IND期间澄清对研发项目预期的FDA指南/会议提高了NDA/BLA的质量
§ 新分子实体(NME)项目 – 在递交时完整的申请和与申办人更多的互动以解决缺陷
§ 靶向治疗 – 在选定患者中的更高获益/更低风险
§ 更多孤儿药 – 改变获益/风险平衡
§ 突破性治疗(BT)认定 – 申办人和FDA“全员行动”
§ 关注申办人远离“me too”药品和较差获益/风险平衡治疗选择的疾病
o 从公众健康角度不一定是好结果
幻灯片包含大量有用且重要的事实和数据,值得花时间仔细阅读!
整理:识林-椒

 产业资讯
产业资讯
 研发客
研发客  2025-07-19
2025-07-19
 17
17

 产业资讯
产业资讯
 动脉网
动脉网  2025-07-19
2025-07-19
 17
17

 产业资讯
产业资讯
 阿基米德Biotech
阿基米德Biotech  2025-07-19
2025-07-19
 19
19