 产业资讯
产业资讯
 2015-11-12
2015-11-12
 3619
3619
来源:赛柏蓝 2015-11-12
自从国务院印发《关于改革药品医疗器械审评审批制度的意见》之后,药品集中评审终于加速。从临床自查到集中审评,CFDA为解决药品积压问题频频出招。本文将对2015年10月CDE药品审评情况进行分析。
一、10月份新药受理情况
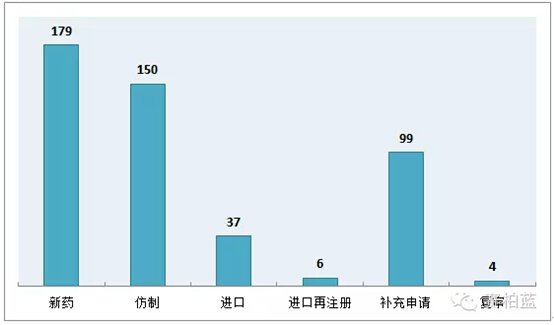
10 月份 CDE 共承办新的化药注册申请以受理号计 475 个,其中申请类型中以新药数量最多,高达175个;其次为仿制药,申报数量也达到150个。
图1:2015年10月化药申报受理情况
二、多家企业亮相1.1类新药申报
根据药品评审数据统计,10 月份CDE共承办化药1.1类新药申请以受理号计有17 个,涉及 8个品种,均为临床申请。具体情况见下表:
表1:2015年10月CDE承办化药1.1类新药情况
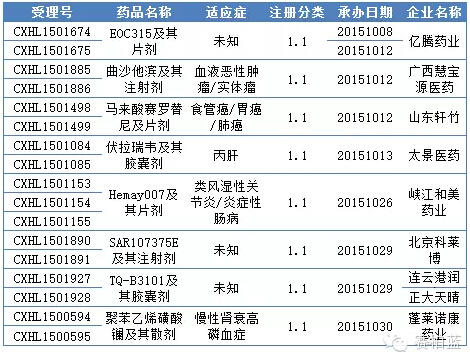
在10月份新申报的1.1类新药中,尤其值得关注的亮点是广西慧宝源医药的曲沙他滨,据悉这是广西自治区有史以来医药企业申报的第一个1.1类新药。
曲沙他滨是新型抗肿瘤胞苷类似物,为全新非天然结构和独特作用机制的化学新药,用于血液恶性肿瘤和实体瘤,对多种癌症均有显著的疗效。
广西慧宝源医药是由美国耶鲁大学归国学者创建,拥有以耶鲁大学终身教授郑永齐院士为核心的研发团队,掌握了一类创新药物的研发通路及中药国际化核心技术。该企业在新药研发方面,与浙江贝达药业极其相似,有可能再现中国化药领域“盐酸埃克替尼”的奇迹。
三、药品集中评审发威,临床批件出现井喷
根据药品评审数据显示(图2),从9月到10月期间,药品审结数量呈现飞跃式增长。同时,据统计,10月份期间评审状态由“在审评”变更为“在审批”的受理号就达到了1300多个,药品集中审评将继续发威。
图2:7-10月CFDA药品审结量情况
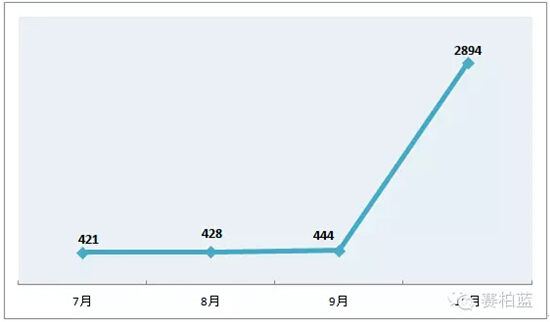
从7月开始,CDE开始了集中审评,至10月31日为止,CDE审评完结的受理号达到了2894个,较9月增长高达551.8%。10月份药品集中审评成效初现,迎来了全年最高完成审评数量。
相信随着药品集中评审的继续推进,药企在获取临床批件方面将不再如以往那样难于登天,高效的评审工作将给药企带来极大的利好。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 144
144

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 146
146

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 147
147