 政策法规
政策法规
 Insight医药情报局
Insight医药情报局
 2019.05.23
2019.05.23
 5716
5716
刚刚,国家药监局通知,「重组带状疱疹疫苗」和「地舒单抗注射液」获批进口! 2 个均为第一批临床急需境外新药。

图片来源:Insight医药情报局
2 批名单,共 78 个临床急需新药
截至目前,CDE 共发布 2 批临床急需境外新药名单,共包括 78 个新药,全部都是国内缺乏的救命新药,主要针对罕见病、国内尚无有效治疗手段的药品、与现有治疗手段相比具有明显临床优势的新药。
在 2018 年 11 月 1 日,CDE 公布第一批名单的同时宣布,已经有 8 个在我国获批上市,那么半年以后,又有哪些临床急需境外新药品种在我国获批上市了?又有哪些企业的品种开始申报了?
政策依据
2018 年,药监局发布临床急需境外新药审评审批相关公告,此后,临床急需境外新药在中国的上市正式进入“跑步”阶段。
政策给临床急需境外新药在国内的获批开辟了加速通道,申请人在证明不存在人种差异的基础上,可以直接提出上市申请;这一政策,至少将国外新药在中国上市的时长缩短 1-2 年。
15 个品种获批上市,平均时长 9.9 个月
根据每个品种在中国的审评时长统计发现,除了赛诺菲「特立氟胺」和吉利德「恩曲他滨/替诺福韦酯艾拉酚胺/艾维雷韦/可比司他」分别于 2014 年和 2016 年申报上市外,其余品种均为 2017 年及以后开始报产,从申报上市到获批上市平均时长为 9.9 个月。
15 个获批上市的品种中,有4 个罕见病用药。
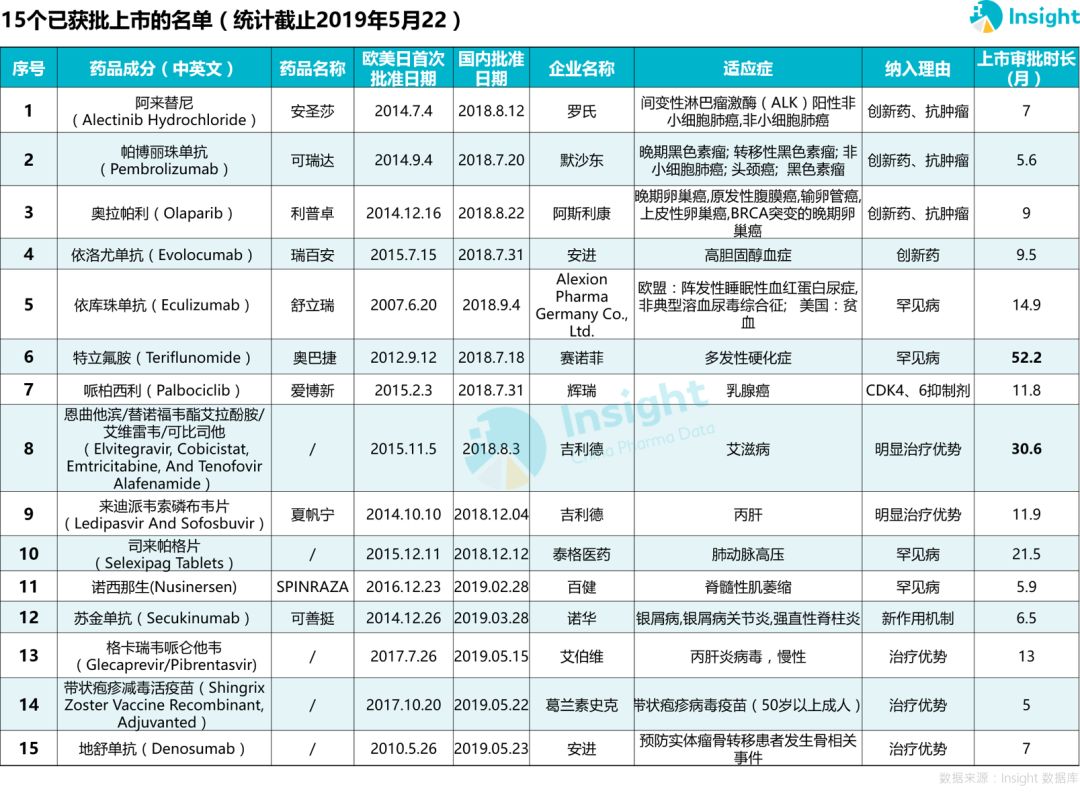
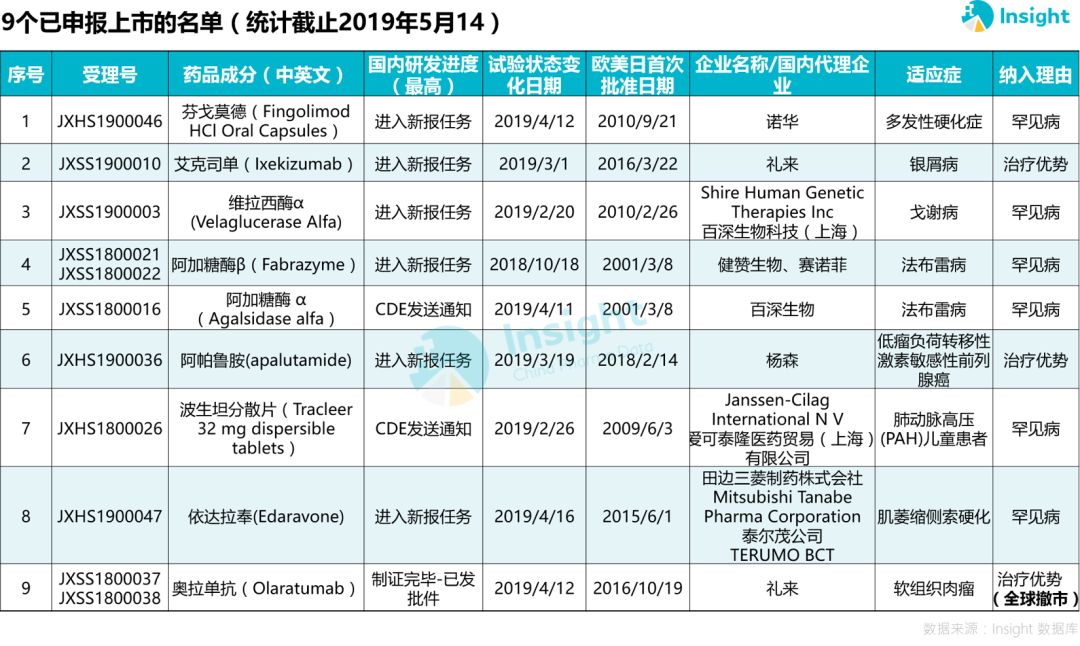
27 个药品开始申报,9 个已报上市
据 Insight 数据库统计,76 个品种除去已获批上市的 15 个,已经有 27 个品种启动国内申报,启动率达到 53.8%。
分析报上市的 9 个品种发现,有 6 个为罕见病用药,预计会在 2020 年相继获批上市。
这在很大程度上得益于国家对罕见病、重大疾病等的药品政策红利,努力缩小国内与全球用药可及性的差距。
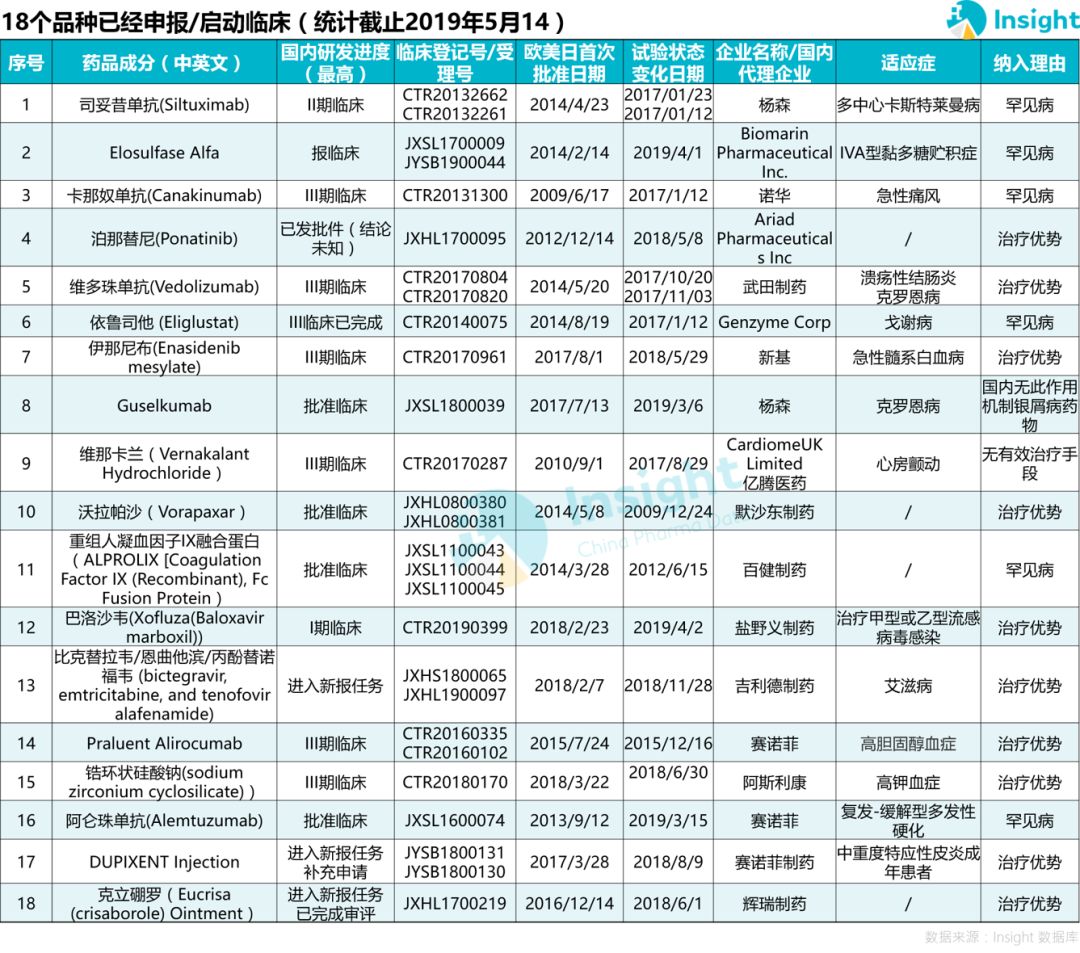
此外,还有 18 个品种已经申报/启动国内临床。
36 个品种暂未开展国内申报
还有一批药品,至今未查询到在国内的申报情况,一共有 36 个品种,其中罕见病药物有 20 个。
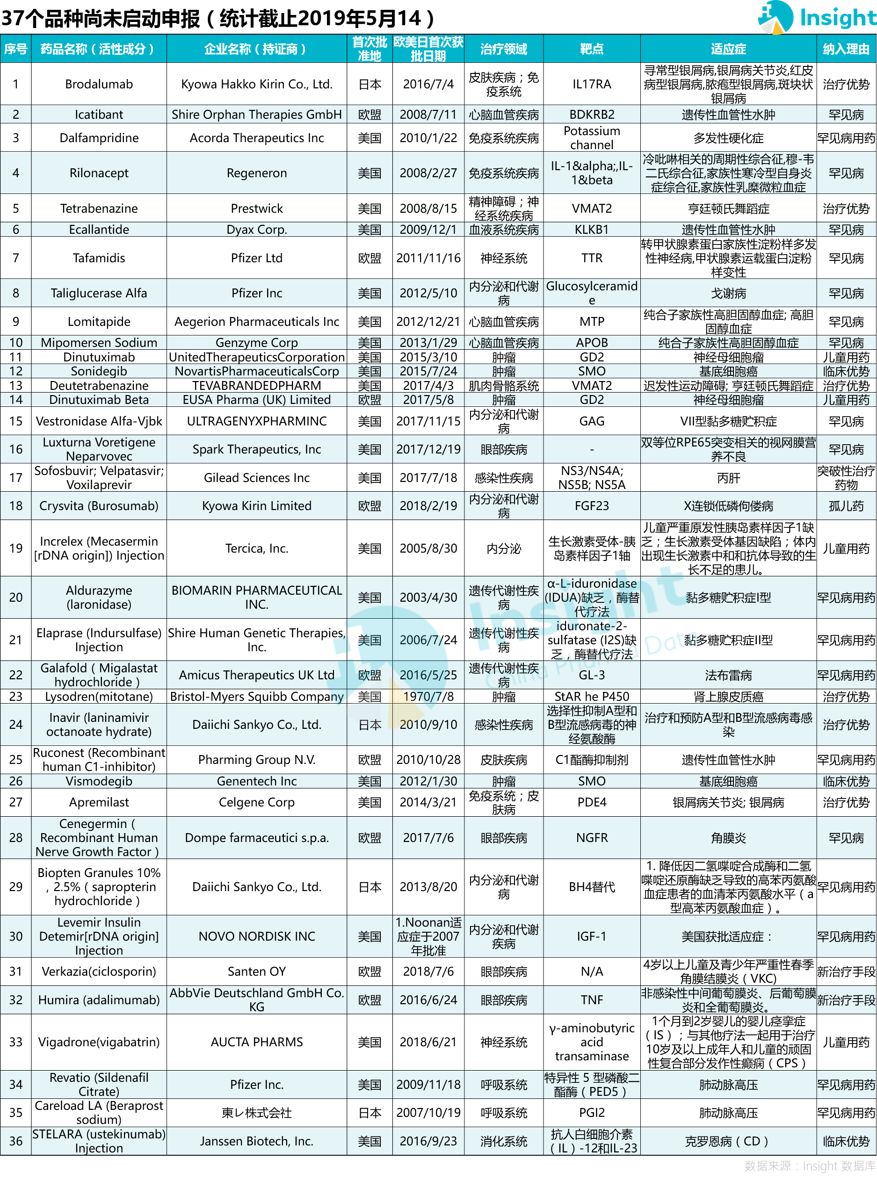
目前全球已知罕见病有 7000 多种。罕见病发病率低,患者少,市场需求少,药物研发周期和成本较高,因此长期以来研究进展缓慢,国产罕见病药物更是少之又少;这种情况下,引进境外已获批的新药,成了最快、最直接的解决用药可及性的手段。
结语
总体看来,78个临床急需境外新药名单中的品种申报启动率比较高,为53.8%,预计这些新药会在 2020 年陆续获批上市;届时,相关疾病无药可用或用药不合理的局面会得以改善。
国家对于临床急需境外新药的包容性给予广大患者带来希望,同时也给了外资企业拓展中国市场增加了一剂催化剂;然而,这对于国内的制药企业来说,尤其是立足于新药研发的企业,则是巨大挑战,因为这加剧了国内创新药研发的激烈程度。
所以,在未来创新药的大环境下,只有那些坚持高质量、高标准的企业才能在激烈的竞争中站稳脚跟。

 国家药品监督管理局
国家药品监督管理局
 2018.07.10
2018.07.10
 12797
12797

 国家药监局
国家药监局
 2020.04.03
2020.04.03
 12075
12075

 国家药监局
国家药监局
 2018.07.26
2018.07.26
 11524
11524