 协会活动
协会活动

 2020.02.25
2020.02.25
 4912
4912
2019年底,新型冠状病毒感染肺炎肆虐全国,疫情发生后中央高度重视,习近平总书记在中央全面深化改革委员会第十二次会议上明确指出,“要从体制机制上创新和完善重大疫情防控举措,健全国家公共卫生应急管理体系,提高应对突发重大公共卫生事件的能力水平”。
中国医药创新促进会(以下简称“我会”)作为致力于推动医疗卫生体制机制创新发展,保障人民群众健康的专业性团体,积极响应国家号召,按照习总书记指示精神,紧急组织力量认真研究美国日本等发达国家应对突发重大公共卫生事件药品紧急授权使用制度(EUA),在充分借鉴国际成熟经验的基础上并结合我国国情,形成了《关于建立我国突发卫生公共事件药品紧急授权使用制度的建议》(以下简称“建议”)并报送中共中央全面深化改革委员会办公室和国务院医药卫生与科技等有关行政管理部门。
建议主要包括三大大内容:
一、建议修改相关法律并制定行政法规,为建立药品紧急授权提供法律依据
建议通过立法或修法授权为建立我国药品紧急授权使用制度及相关管理体系奠定法律基础。由国家药品管理行政部门制定药品紧急授权使用制度及实施方案,报请国务院批准并颁布相关行政法规作为《突发事件应对法》和《药品管理法》的配套法规,以规范应急药品的特别审批与使用管理,明确发生重大突发公共卫生事件或严重威胁生命健康疾病时,授权国家药品监管部门紧急临时批准特定医疗产品(化学药品、中成药、生物制品和诊断医疗器械),用于突发事件及重大传染性疾病的预防、诊断和治疗。
二、建立药品紧急授权使用制度特别审批程序
建议基于“快速审批、快速使用、快速调整”原则,建立我国药品紧急授权使用(CEUA)制度。建议内容包括CEUA的启动,适用品种范围、申报要求与审评审批要点,CEUA 药品使用风险控制和监管,建立CEUA 与正常上市许可转化与激励机制,建立CEUA 授权责任豁免机制以及CEUA 授权终止后的监管等六大部分内容。
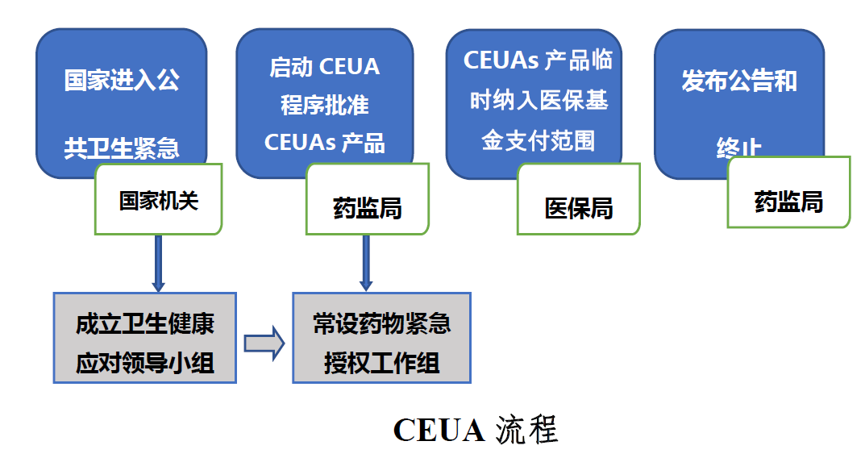
(一)药品紧急授权使用(CEUA)启动
当国务院或国务院授权有关部门宣布进入突发公共卫生事件防控紧急状态时,国家药品监督管理局(NMPA)即启动药品紧急授权使用制度。
组建由药品与卫生行政管理部门与相关机构组成的CEUA专业领导工作组,负责确定发布适用CEUA医药产品的范围,研究制定CEUA适用产品风险效益评价策略,以及研究制定加快应对突发公共卫生事件的潜在医药产品审评审批政策与相关EUCA产品使用监管评估策略。
按照申报或潜在CEUA 产品分类,成立CEUA 专项审评工作组,以加快CEUA产品审批。
(二)CEUA申报要求与审评审批
建议对CEUA适用产品范围、申报主体以及适用未满足临床需求的情形等进行了研究,并提出除了没有有效治疗产品外,未满足临床需求还应包括已批准上市药品生产能力不足、已批准上市药品有特殊禁忌人群和产品剂型不适宜特殊人群服用以及不适宜急救治疗等。
建议还针对新申请药物、增加新适应症以及授权仿制与依法开展强制许可仿制等不同产品类别的申报要求,提交研究数据、报告证据级别,审评原则与评价方法等进行研究并提出原则性建议:
提交IND或NDA申请的在研药物可以申报CEUA;国外已上市产品或者未上市药物可以使用国际多中心临床试验数据或者符合法定要求的境外临床试验数据提交申请;列入国家或者省级应急准备科研计划项目或国家应急准备紧急科技项目的药物可以直接提交申请。
未上市药品除需要提交拟用适应症和用法,产品作用机理等基本资料外还应提交质量研究报告、非临床研究报告以及临床研究报告;已批准上市药品增加新适应症的,如新用途对患者群体引入新的风险,则要求提供体外试验、动物毒性试验或者人体临床使用经验和数据,否则可以上市批准数据支持申报;授权或强制仿制药品按照药品注册法规要求提交基本资料与生物等效性试验或者体外研究资料。
产品审查期间,应及时提交可能改变对产品安全性或有效性评价的所有试验数据(例如长期稳定性研究数据,在紧急状态期间与CEUA同时进行的相关对照临床试验数据)。
CEUA专项审评员可与CEUA产品申报者或者潜在的CEUA药品(特别是处于研发后期的药物)持有人就申报要求或关键技术问题进行沟通和交流,以提升申报资料的完整性并加快审批。
CEUA专项审评工作组对提交数据的数量与质量进行评估,对符合要求的证据进行全面风险效益评价,符合要求的NMPA可以批准紧急使用。CEUA产品有效期应不长于紧急状态的期限。紧急状态终止,CEUA授权效力即终止,所有CEUA产品将不再用于除依法开展的临床试验以外的治疗。
为提高紧急状况下CEUA产品信息传递效率,NMPA或相关部门可在官网发布CEUA产品所有相关信息供公众阅读,包括批准的CEUA产品名称、授权通知、产品说明书(医务人员版、患者版)、产品制造商信息,并及时更新产品信息。
建立不良反应监测与动态评价机制,保障CEUA产品的安全使用。
三、建立应急药品监管政府协同机制
由国家卫健委组织药监局、科技部、发改委、工信部、医保局、社会保障部等相关部门成立卫生健康紧急应对领导小组。为应对未来重大突发公共卫生事件发生,研究制定公共卫生健康威胁防控应对战略与措施;制定国家应对突发公共卫生健康威胁的治疗药物研发与流行病基础研究规划;以及鼓励国产应急药物如抗病毒药物研发应用的创新激励机制。
建立药监和医保管理部门的实时联动机制,药品监管部门依照CEUA 程序批准产品上市及扩大适应症的已上市药品,医保管理部门自动将其纳入医保临时报销目录。建立由国家相关部门统一调配的CEUA 产品使用流通机制,以保障CEUA产品使用配送系统有效运行。

 中国药促会
中国药促会
 2020.06.30
2020.06.30
 27019
27019

 中国医药创新促进会
中国医药创新促进会
 2021.03.03
2021.03.03
 21347
21347

 中国药促会
中国药促会
 2021.03.24
2021.03.24
 19894
19894