 会员动态
会员动态
 先声药业
先声药业
 2021.12.01
2021.12.01
 1938
1938
2021年11月29日,先声药业(2096.HK)宣布,向国家药品监督管理局递交的骨髓保护创新药注射用曲拉西利(Trilaciclib)上市许可申请(NDA)获受理。
从引进到递交NDA用时15个月,彰显先声速度
曲拉西利为先声药业与G1 Therapeutics合作开发的全球首个且唯一具有全面骨髓保护功效的药物,是可以减少化疗导致的骨髓抑制(CIM)的一种全新疗法,曾获美国食品药品监督管理局(FDA)“突破性疗法”认定,并于今年2月在美上市(商品名:COSELA™)。在中国申请的首个适应症为在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌患者中预防性使用,以降低化疗引起的骨髓抑制的发生率。
此次递交中国上市许可申请距离引进曲拉西利15个月,距在美上市仅用时9个月,体现了先声药业极高的研发效率和“让患者早日用上更有效药物”的企业使命。
用于支持中国上市申请的数据包括了先声药业与合作伙伴在境内外开展的多项临床研究的结果,这些研究均证实曲拉西利在中国患者与境外患者具有一致的药物代谢动力学(PK)特征和临床获益趋势,且未发现新的安全性信号。
中国每年新发肿瘤病例超过400万,化疗是最基础的治疗手段。然而骨髓抑制这一常见的副作用会造成患者感染、贫血、自发性出血、休克甚至是死亡,严重降低了患者的生活质量,缩短了生存时间。骨髓抑制发生后需要进行医疗干预,增加了医疗成本和患者身心负担,同时往往不得不降低抗肿瘤药物剂量或中断治疗,导致化疗时间延迟、疗效减弱、疾病进展,影响了抗肿瘤治疗的整体获益。
骨髓抑制一直缺乏特别有效的疗法和预防手段,只能在发生后通过输血、注射生长因子或输血小板进行“补救”,但这些疗法仅能针对性改善某一类血细胞,而且可能会带来额外的风险。因此,广大的化疗患者对于能够改善化疗副作用,又不降低抗肿瘤的疗效的新疗法存在迫切需求。
全新机制,为“化疗”保驾护航
相比于传统手段,曲拉西利以一种全新机制减少小细胞肺癌患者因化疗引起的骨髓抑制的发生。
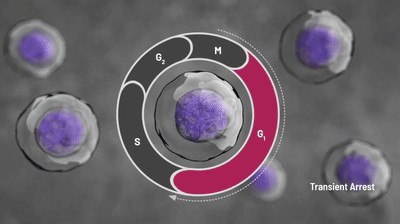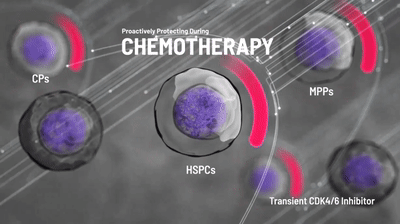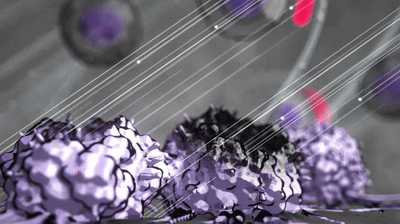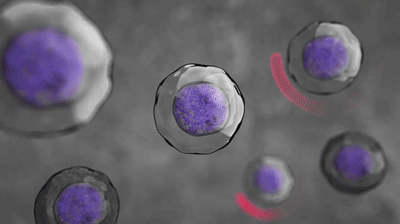
化疗药物可以杀伤快速分裂的肿瘤细胞,然而骨髓细胞由于同样具有活跃分裂的性质,也会受到化疗药物的影响。作为一种细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂,曲拉西利可以将骨髓中的造血干/祖细胞等暂时地阻滞在细胞周期的G1期,让细胞暂时停止分裂,从而免受化疗药物的杀伤。
2020年8月与G1 Therapeutics达成授权协议后,先声药业快速推进了曲拉西利在多个癌种中的临床试验,于2021年1月获批启动中国小细胞肺癌III期临床试验。同时,在海南博鳌乐城先行区开展真实世界研究,为该产品在中国的早日落地累积了真实世界证据。
先声药业希望通过与合作方的共同努力,让中国广大接受化疗的广泛期小细胞肺癌患者早日用上这一创新产品,降低化疗带给肿瘤患者的骨髓抑制风险,为患者生命保驾护航。
关于曲拉西利(Trilaciclib)
曲拉西利在化疗导致的骨髓抑制适应症中为一款First-in-Class疗法,曾被美国FDA授予突破性治疗认定和优先审评资格。2021年,曲拉西利被纳入美国国家综合癌症网络(NCCN)指南(《小细胞肺癌(V3)》及《造血因子(V2)》)。除小细胞肺癌外,G1公司启动了曲拉西利在三阴性乳腺癌及转移性结直肠癌(mCRC)的Ⅲ期临床试验,关于乳腺癌新辅助化疗、非小细胞肺癌二线治疗以及膀胱癌一线治疗的探索性研究也在境外进行中。
先声药业负责曲拉西利在大中华地区(中国大陆、香港、澳门和台湾)所有适应症的开发和商业化,目前正在开展曲拉西利在小细胞肺癌、结直肠癌、三阴性乳腺癌三项适应症的III期临床试验。

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27614
27614

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15497
15497

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14954
14954