 研发追踪
研发追踪
 药渡Daily
药渡Daily  2022-07-11
2022-07-11
 3347
3347
2022年7月5日,Genentech宣布,FDA日前受理公司的first-in-class双特异性抗体Mosunetuzumab的BLA申请,并同时授予该产品优先审评资格,适应症为复发性/难治性(R/R)滤泡性淋巴瘤(FL)成人患者,这些患者此前至少接受过2次系统治疗。
来源:Genentech官网
此次BLA是基于Mosunetuzumab的一项名为GO29781的关键I/II期临床研究的积极结果。该研究数据显示,在先前接受过2次或2次以上治疗的R/R FL患者中,Mosunetuzumab诱导了持续至少18个月的持久完全缓解,完全缓解率(CR)为57% [95% CI:49-70]),并且显示了可控的耐受性。中位无进展生存期(PFS)为17.9个月(95%CI:10.1-不可评估)。在病情缓解的患者中,中位缓解持续时间(DOR)为22.8个月(95%CI:9.7-不可评估)。最常见的不良反应事件(AE)是细胞因子释放综合征(39%;n=86/218),通常为低别级(1级:25.6%;2级:14%;3级:2.3%;4级:0.5%),停药后会消退。其他常见的不良反应事件(AE)(>20%)包括:疲劳、头痛、中性粒细胞减少、发热和低磷血症。治疗是在没有强制住院治疗的情况下进行的,由此可见,Mosunetuzumab具有很高的安全性。该结果已于2021年12月在第63届美国血液学会(ASH)年会暨博览会上首次公布。GO29781研究(NCT02500407)是一项I/II期、多中心、开放标签、剂量递增和扩展的临床研究,旨在评估Mosunetuzumab在复发或难治性B细胞非霍奇金淋巴瘤患者中的安全性,有效性和药代动力学特征。研究终点指标包括独立评价机构(主要终点)的完全缓解率(最佳反应)、客观缓解率、反应持续时间、无进展生存期、安全性和耐受性(次要终点)。
关于滤泡性淋巴瘤(FL)
滤泡性淋巴瘤(FL)是一种滤泡生发中心B细胞转化来的惰性成熟B细胞非霍奇金淋巴瘤(NHL),发病率仅次于弥漫大B细胞淋巴瘤(DLBCL),占美国所有成人NHL的20-40%,在欧洲和亚洲较少见。它通常对治疗应答良好,但又特别容易多次复发。患者再次复发时,会变得更难治疗,早期进展可能与长期预后不良有关。预计2022年美国将有13,000名患者被诊断为FL。庞大的FL患者群体急需疗效更好的药品。此次Mosunetuzumab向FDA递交BLA,无疑是“雪中送炭”。预计FDA将在2022年12月29日之前给出裁决。
关于Mosunetuzumab
Mosunetuzumab是Genentech研发的CD20/CD3双特异性抗体,通过同时结合2种不同细胞上的2个不同靶点(恶性B细胞表面的CD20,T细胞表面的CD3)来发挥作用。这种双重靶向作用可激活和重新定向患者现有的内源性T细胞,结合并通过向目标B细胞内释放毒性蛋白来消除这些恶性B细胞。这种双重靶向疗法,为包括非霍奇金淋巴瘤(NHL)和多发性骨髓瘤(MM)在内的血液肿瘤提供了一种创新的治疗方法。
目前,Mosunetuzumab仍在开展多项临床研究,包括联合来那度胺二线治疗FL的CELESTIMO研究以及联合维博妥珠单抗二线治疗弥漫性大B细胞淋巴瘤 (DLBCL)的SUNMO研究等两项III期临床试验。
Mosunetuzumab研发进展

来源:药渡数据库
研发里程碑
2022年7月5日,Genentech向FDA提交Mosunetuzumab的BLA申请,同时获FDA授予优先审评资格认定。
2022年6月3日,Mosunetuzumab获EMA批准上市,批准适应症为复发性/难治性滤泡性淋巴瘤(FL)。
2021年4月21日,Mosunetuzumab获CDE临床默示许可,适应症为复发性/难治性滤泡性淋巴瘤(FL)。
2020年7月14日,Mosunetuzumab被FDA授予突破性疗法认定,适应症为复发性/难治性滤泡性淋巴瘤(FL)。
2018年12月17日,Mosunetuzumab被CDE授予孤儿药资格认定,适应症为复发性/难治性滤泡性淋巴瘤(FL)。
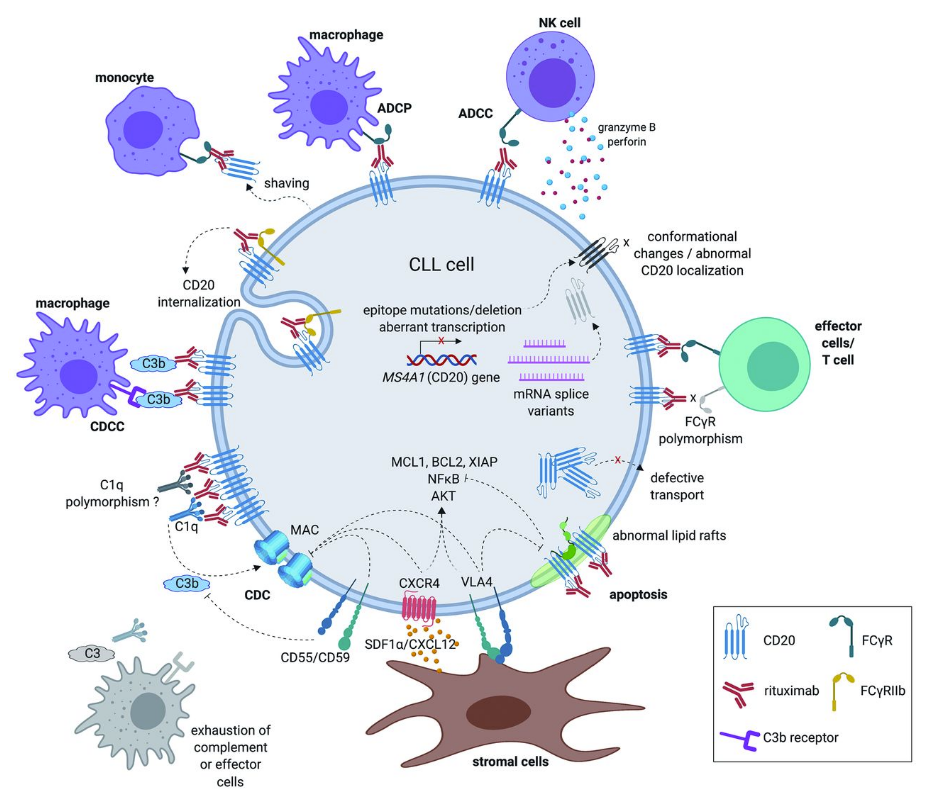
关于CD20/CD3靶点
CD20是一种在淋巴B细胞表面表达的糖基化蛋白,该蛋白在B细胞发育周期中表达逐渐升高,但在分化后的正常组织中不表达。CD3是存在于T细胞表面的跨膜蛋白,CD3分子通过盐桥与T细胞抗原受体(T cell receptor,TCR)相连,参与T细胞的信号转导,能够将T细胞募集至肿瘤细胞周围,并激活T细胞来杀灭肿瘤细胞,为一些耐药复发或难治的非霍奇金淋巴瘤(NHL)、多发性骨髓瘤(MM)等血液肿瘤患者提供了一种创新的治疗手段。CD20作用机制
来源:参考来源3
CD20/CD3靶点竞争格局
在研CD20/CD3双抗

来源:药渡数据库
根据药渡数据库调研,目前CD20/CD3双抗赛道竞争激烈。国外进展最快的Gennetech的Mosunetuzumab,已于今年6月获EMA批准上市,适应症为复发性/难治性滤泡性淋巴瘤。其次是Genmab/艾伯维的Epcoritamab,2022年6月向FDA提交上市申请,适应症为B细胞淋巴瘤。另外,罗氏的Glofitamab和再生元的Odronextamab,目前的最高研发状态均为III期临床。
在国内,目前已经有多款CD20/CD3双抗药物进行临床试验,包括诺诚健华/康诺亚的CM-335、成都恩沐/海正/博锐生物的1-A-46、嘉和生物的GB-261、广州爱思迈的EX-103等,上述药物均处于I/II期临床研究阶段;此外,君实生物的JS-203正在申报临床。
英文原文:https://www.gene.com/media/press-releases/14958/2022-07-05/fda-grants-priority-review-to-genentechs

 研发追踪
研发追踪
 DailyBio
DailyBio  2025-05-12
2025-05-12
 193
193

 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-05-12
2025-05-12
 192
192
 研发追踪
研发追踪
 药明康德
药明康德  2025-05-12
2025-05-12
 199
199