 研发追踪
研发追踪
 医药魔方Info
医药魔方Info
 2022.07.25
2022.07.25
 1576
1576
7月21日,默沙东公布Keytruda(帕博利珠单抗)联合放化疗(CRT)用于未切除的局部晚期头颈部鳞状细胞癌(HNSCC)患者的III期KEYNOTE-412研究未达到改善无事件生存期(EFS)的主要终点。

KEYNOTE-412是一项随机、双盲的III期试验研究,旨在探究Keytruda 200mg(Q3W)联合CRT序贯Keytruda维持治疗局部晚期HNSCC相比根治性CRT的疗效和安全性,该研究的主要终点是EFS。该试验招募了约780名新诊断的鳞状细胞癌成人患者,随机接受Keytruda联合CRT,然后接受大约一年的Keytruda维持治疗,或安慰剂加CRT,然后是安慰剂。
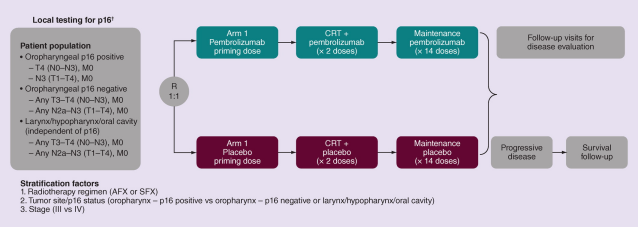
KEYNOTE-412试验方案
KEYNOTE-412数据显示,与安慰剂加CRT相比,接受Keytruda联合CRT治疗患者的EFS虽然有所改善,但未达到预期的统计学意义。该试验中Keytruda的安全性与先前报道的HNSCC研究一致。KEYNOTE-412试验数据将在即将召开的医学会议上公布。
头颈癌是指发生在喉部、鼻子、鼻窦和嘴巴内部等的癌症。大多数头颈癌是鳞状细胞癌,起源于构成头颈部结构薄表层的扁平鳞状细胞。头颈癌的主要诱因包括吸烟、饮酒以及人乳头瘤病毒 (HPV)。据估计,2020年全球新诊断出超过930,000例头颈癌病例,超过465,000人死于该疾病。据估计,2022年,美国将有超过66,000例新诊断的头颈癌病例,超过15,000人死于该疾病。
Keytruda目前在美国、欧洲、中国、日本和世界其他国家被批准作为单一疗法和联合疗法用于适当的转移性或不可切除、复发性HNSCC患者。默沙东目前在HNSCC研究领域拥有最大的免疫肿瘤临床开发项目,并将继续推进Keytruda作为单一疗法和与其他药物联合使用的多项注册研究,包括用于可切除局部晚期HNSCC的新辅助和辅助治疗的KEYNOTE-689研究。
Keytruda是由默沙东开发的一款PD1单抗,2014年率先在美国上市,2018年在中国上市,目前已在全球获批超20种适应症。上市以来,自2018年K药销售额反超BMS的O药后,就一直保持快速增长趋势,蝉联PD-1/PD-L1单抗的销售“王座”。
2021年,K药全年销售额高达172亿美元,同比增长20%。这主要是因为其在NSCLC、三阴乳腺癌、肾细胞癌、头颈鳞癌、MSI-H等关键癌种继续渗透,并占据较大市场优势,同时临床用药方面也开始更多向早期一线用药转移。2022年默沙东预计Keytruda会突破200亿美元大关,其核心专利到期时间是2028年。
参考文献
https://doi.org/10.2217/fon-2020-0184

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34376
34376

 医药地理
医药地理
 2018.10.22
2018.10.22
 18833
18833

 医谷
医谷
 2019.03.18
2019.03.18
 18792
18792