 研发追踪
研发追踪
 医药魔方
医药魔方
 2022.08.01
2022.08.01
 3275
3275
7月26日,渤健(Biogen)和Ionis pharmaceuticals共同宣布,FDA已接受其在研反义寡核苷酸疗法tofersen(BIIB067)的上市申请,用于治疗超氧化物歧化酶1 (SOD1)突变所致的肌萎缩侧索硬化(ALS)。FDA同时授予其优先审评资格,PDUFA日期定于2023年1月25日。
ALS是一种进行性神经退行性疾病,平均死亡时间为三至五年,最常见的死因是呼吸衰竭。SOD1-ALS是ALS的一种罕见遗传性形式,仅占全球约16.8万ALS病例的2%。目前,没有针对ALS的基因靶向疗法获批。
Tofersen是一种用于治疗SOD1-ALS的反义寡核苷酸药物。Tofersen可与编码SOD1的mRNA结合,使其被核糖核酸酶降解,从而减少SOD1蛋白的产生。
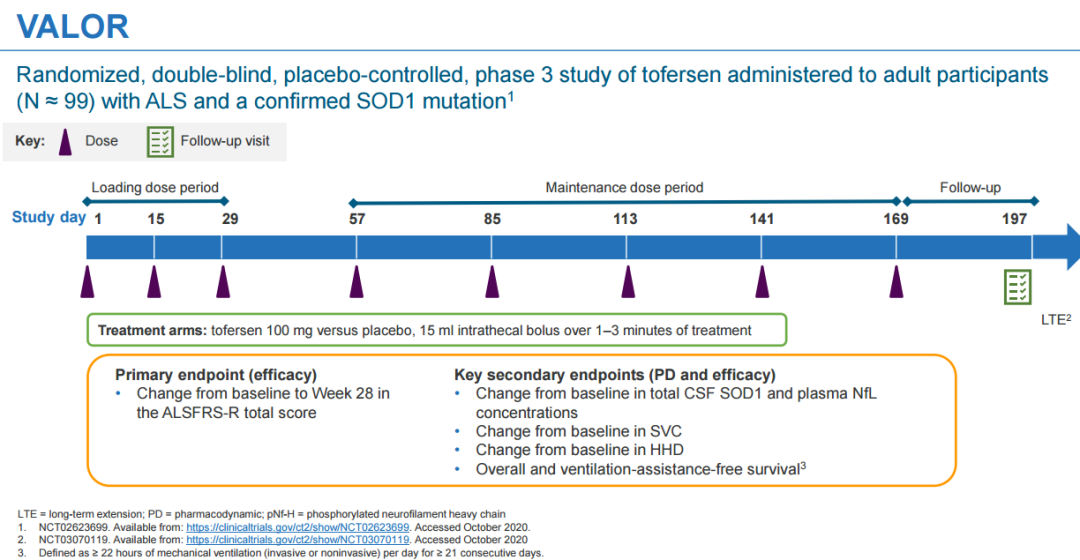
Tofersen的新药申请包括在健康志愿者中的I期临床试验、I/II期多剂量爬坡(MAD)临床试验、III期临床试验VALOR以及开放标签扩展 (OLE)的研究结果。同时也包含了最近12个月VALOR和OLE研究的整合结果,该研究最近在欧洲治愈ALS网络 (ENCALS) 年会上发表。 此前所公布的关键III期VALOR研究结果显示,其并未达到修订版肌萎缩侧索硬化功能评定量表 (ALSFRS-R)中从基线到第28周评分变化差异的主要终点。然而,生物活性和临床功能的多项次要和探索性终点分析显示疾病进展有减缓的趋势。近期公布的12个月整合性数据显示,早期使用tofersen可持续减少神经微丝(神经退行性疾病的生物标志物)数目,且减缓许多疗效终点的下降。
在此12个月的数据当中,接受tofersen治疗的患者最常见的不良反应为头痛、操作性疼痛、跌倒、背痛与肢体疼痛等。VALOR和OLE中的大多数AE严重程度为轻度至中度。约有6.7%的患者出现严重的神经性相关事件,包含脊髓炎、神经根炎、无菌性脑膜炎与视神经乳头水肿。
渤健的全球安全与监管科学负责人兼临时研发负责人Priya Singhal博士说道,“若是获得批准,tofersen将会是第一个靶向ALS遗传因子的疗法。我们希望这将会为此疾病的未来疗法铺路。”

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34364
34364

 医药地理
医药地理
 2018.10.22
2018.10.22
 18828
18828

 医谷
医谷
 2019.03.18
2019.03.18
 18784
18784