 会员动态
会员动态
 信达生物
信达生物
 2022.11.10
2022.11.10
 1966
1966
2022年11月9日,美国罗克维尔和中国苏州——信达生物制药集团(香港联交所股票代码:01801),一家致力于研发、生产和销售用于治疗肿瘤、自免、代谢、眼科等重大疾病领域创新药物的生物制药公司,宣布:信达生物与亚盛医药合作的中国原创1类新药奥雷巴替尼(商品名:耐立克®)共有三项临床进展获选第64届美国血液学会(American Society of Hematology,ASH)年会口头报告。这是该品种的临床进展连续第五年入选ASH年会口头报告,充分体现国际血液学界对其疗效和安全性的认可。
酪氨酸激酶抑制剂(TKI)是治疗慢性髓性白血病(CML)和费城染色体阳性急性淋巴细胞白血病(Ph+ALL) 的基石,然而耐药一直是困扰临床诊疗的难题,尤其是BCR-ABL1激酶区T315I突变,对目前中国市场已上市所有TKI均耐药。耐立克®是中国首个且唯一获批上市的伴T315I突变治疗有效药物,为耐药CML患者和Ph+ALL患者的诊疗带来福音,打破了耐药患者长期无药可医的困境。
耐立克®的临床进展已连续五年入选ASH年会口头报告,且今年耐立克®有3项口头报告在ASH年会闪耀汇报。其中,该品种首个海外临床研究数据显示,即使是多线耐药,普纳替尼(Ponatinib)耐药、Asciminib耐药、非T315I突变的CML及Ph+ALL患者,耐立克®都表现出极强的疗效,且安全可耐受。同时,耐立克®Ⅰ期临床研究5年随访数据及II期临床试验最新结果再次证实了耐立克®良好的长期疗效及安全性。耐立克®最新进展有望为全球耐药CML和Ph+ALL的患者治疗带来全新变革。
耐立克®首个海外临床研究报告
耐立克®海外临床研究数据首次对外重磅公布,立刻引起全球血液病领域专家广泛关注。该研究是一项多中心、开放标签、随机临床研究(NCT04260022),来自MD安德森癌症中心等研究机构,主要研究者(Leading PI)是全球著名血液肿瘤专家、MD Anderson癌症中心白血病科主任Hagop Kantarjian教授。研究纳入30例患者(CP-CML 23例,AP-CML 4例,BP-CML 2例,Ph+ALL 1例),患者至少对2种TKIs耐药或不耐受,其中21例患者(耐药17例,不耐受4例)曾经接受过三代TKI普纳替尼治疗,有5例患者曾经接受过Asciminib治疗;有12例患者伴有T315I 突变。中位年龄为47.0(21.0-74.0)岁,中位治疗持续时间为4.8(0.03-21.29)个月。
疗效评估
21例耐药患者可评估疗效,17例患者可评估细胞遗传学反应,58.8%(10/17)患者达CCyR;42.9%(9/21)患者达到MMR。
在T315I突变或非T315I突变患者中,奥雷巴替尼均表现出良好疗效。T315I突变患者(CcyR,62.5%;MMR,50%)和非T315I突变患者(CCyR 55.6%,MMR 38.5%,),且有效性并未因既往使用普纳替尼或Asciminib而受损。
既往接受普纳替尼和Asciminib治疗的患者中,奥雷巴替尼同样具有良好的疗效。在既往接受普纳替尼治疗的患者中,55.6%(5/9)普纳替尼耐药患者达到CCyR,54.5%(6/11)达到了MMR。既往接受Asciminib治疗的5例患者,4例也具有良好的疗效反应。
安全性分析
22例(73.3%)患者经历了任何级别的治疗相关不良反应(TRAE),其发生率呈剂量依赖性。
大多数非血液学TRAE为1/2级,常见的3/4级血液学TRAE包括血小板减少症(7/30;23.3%)、中性粒细胞减少症(5/30;16.7%)和白血球减少症(4/30;13.3%)。
研究结论
该研究结果显示即使普纳替尼耐药、Asciminib耐药、T315I 突变或非T315I 突变的患者中,奥雷巴替尼对难治性耐药CML和Ph+ ALL患者中均具有良好的有效性和耐受性。
奥雷巴替尼Ⅰ期临床研究5年随访数据
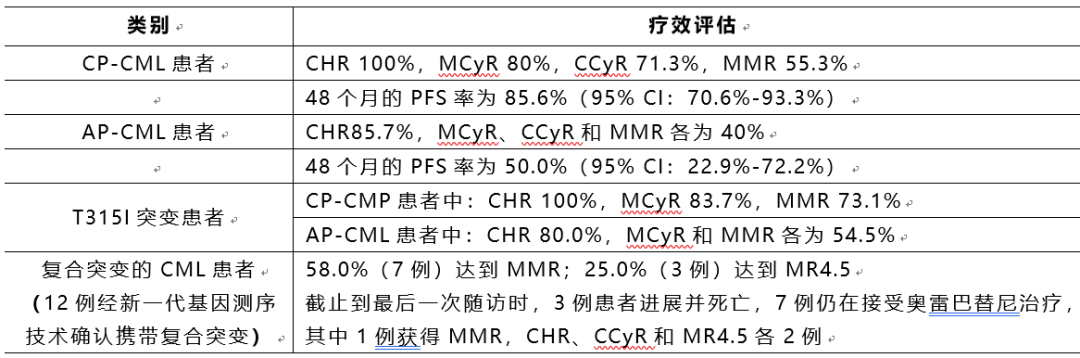
奥雷巴替尼Ⅰ期临床研究5年安全性和有效性随访数据亦做口头报告。Ⅰ期临床研究随访时间从2016年10月26日至2022年4月30日,101例(CP-CML 86例;AP-CML 15例)患者入组并接受了奥雷巴替尼治疗,中位治疗时间为44.7(1.2-63.1)个月。截至数据截止日期,71.3%(72/101)仍然继续接受治疗,28例(21例CP-CML和7例AP-CML)因疾病进展、不耐受或其他原因停止治疗。累积药物暴露的中位剂量20,175(660-34,395)mg。101例患者中,79例(78.2%)治疗>3年,21例(20.8%)治疗>4年,3例(3.0%)治疗>5年。
疗效分析
安全性分析
非血液学不良事件,最常见的为皮肤色素沉着(85.1%);≥3级非血液学不良反应包括高甘油三酯血症(10.9%)、发热(6.9%)和蛋白尿(6.9%)。
血液学相关不良事件,79例(78.2%)患者中发生血小板减少症,其中52例(51.5%)≥3级和7例(6.9%)SAE;21例(20.8%)白血球减少症≥3级,无SAE;17例(16.8%)贫血≥3级,4例(4.0%)SAE。
研究结论
奥雷巴替尼人体试验的5年随访结果显示,奥雷巴替尼在接受过多线治疗的CML患者中,具有良好的安全性和持久疗效,可为耐药CML治疗优选。
奥雷巴替尼关键性II期临床试验最新结果
奥雷巴替尼关键性II期临床试验(HQP1351-CC-201研究和HQP1351-CC-202研究)最新结果亦将在2022ASH进行口头报告展示和交流。
HQP1351-CC-201研究(CP-CML)
纳入41名患者,中位年龄为47(22-70)岁,32名(78.1%)患者既往接受过≥2种TKIs。
疗效评估:CP-CML患者CHR 100%,MCyR 82.9%,CCyR 70.7%,MMR 58.5%。获得CHR的中位时间为1个月(95% CI:1.0-1.9),获得MCyR的中位时间为2.8个月(95% CI:2.8-5.6),获得MMR的中位时间为6.5个月(95% CI:2.8至未达到[NR])。36个月时的无进展生存率(PFS)为86.3%(95% CI:70.2%-94.1%),总生存率(OS)为95.1%(95% CI:81.9%-98.8%)。
安全性分析:常见的TRAE(所有级别;3-4级;SAEs)依次为血小板减少症(70.7%;48.8%;7.3%)、贫血(70.7%;31.7%;2.4%)、白血球减少症(51.2%;14.6%;0)、中性粒细胞减少症(41.4%;21.9%;0)。常见非血液学TRAE(所有分级;3-4级)包括皮肤色素沉着(56.1%;0%)和肌酸激酶升高(56.1%;19.5%)、谷丙转氨酶(ALT)升高(43.9%;2.4%)和谷草转氨酶(AST)升高(36.6%;0)。
HQP1351-CC-202研究(AP-CML)
共有23名患者入组,中位年龄为41(21-74)岁,19名(82.6%)患者既往接受≥2种TKIs。
疗效评估:MaHR 78.3%,MCyR 52.2%,CCyR 52.2%,MMR 47.8%。获得MaHR的中位时间为2.8个月(95% CI:1.0-4.7);获得MCyR的中位时间为5.6个月(95% CI:2.00-NR);获得MMR的中位时间为13.1个月(95% CI:5.6-22.4)。36个月时,PFS率为57.1%(95% CI:33.3%-75.1%),OS率为69.6%(95% CI:46.6%-84.2%)。
安全性分析:常见的TRAE(所有级别;G3-4;SAEs)包括血小板减少症(78.3%;56.5%;17.4%)、贫血(69.6%;34.8%;13.0%)、白血球减少症(56.5%;30.4%;0)、中性粒细胞减少症(26.1%;26.1%;0);常见的非血液学不良事件包括皮肤色素沉着(69.6%)、低钙血症(52.2%)、蛋白尿(56.5%)、高甘油三酯血症(60.9%)、高磷血症(47.8%)、高尿酸血症(26.1%)和关节痛(34.8%),其中以1-2级居多。
研究结论
该研究同样显示奥雷巴替尼对TKI耐药且伴有T315I突变的CP-CML和AP-CML患者具有良好的有效性和耐受性。
信达生物与亚盛医药合作的中国原创1类新药耐立克®,不仅仅突破了伴T315I突变CML治疗耐药困局,亦对多线TKIs耐药的CML和Ph+ ALL患者,即使普纳替尼(Ponatinib)耐药、Asciminib耐药、非T315I突变的患者,均具有良好的疗效和安全性。来自中国“智”造正闪耀2022ASH,将改变全球CML和Ph+ ALL治疗格局,是治疗耐药CML和Ph+ ALL患者优选,惠及全球CML和Ph+ ALL患者。
关于奥雷巴替尼(商品名:耐立克®)
耐立克®是亚盛医药原创1类新药,为口服第三代BCR-ABL抑制剂,是中国首个获批上市的第三代BCR-ABL靶向耐药CML治疗药物,对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果,获国家“重大新药创制”专项支持。
2021年11月,NMPA通过优先审评审批程序附条件批准耐立克®上市申请,用于治疗用于任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I 突变的慢性髓细胞白血病慢性期 (CML-CP) 或加速期 (CML-AP) 的成年患者;2021年3月,该品种被CDE纳入突破性治疗品种,用于治疗一代和二代TKIs耐药和/或不耐受的CML-CP患者。
而在海外,该品种于2019年7月获FDA临床试验许可,直接进入Ib期临床研究;其临床试验进展自2018年开始,连续四年入选美国血液学会(ASH)年会口头报告,并荣获2019 ASH年会“最佳研究”的提名。目前,耐立克®共获1项美国食品药品监督管理局(FDA)审评快速通道资格;3项美国FDA孤儿药资格认定,适应症分别为CML,急性淋巴细胞白血病(ALL)和急性髓系白血病(AML);还获一项1项欧洲药品管理局(EMA)的欧盟孤儿药资格认定,适应症为CML。
2021年7月,亚盛医药(6855.HK)与信达生物制药集团(1801.HK)达成在中国市场就耐立克®共同开发和共同商业化推广的战略合作。
*注 耐立克®为亚盛医药的注册商标
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的理想和目标。信达生物成立于2011年,致力于开发、生产和销售肿瘤、自身免疫、代谢、眼科等重大疾病领域的创新药物。2018年10月31日,信达生物制药在香港联合交易所有限公司主板上市,股票代码:01801。
自成立以来,公司凭借创新成果和国际化的运营模式在众多生物制药公司中脱颖而出。建立起了一条包括35个新药品种的产品链,覆盖肿瘤、自身免疫、代谢、眼科等多个疾病领域,其中7个品种入选国家“重大新药创制”专项。公司已有 8个产品(信迪利单抗注射液,商品名:达伯舒®,英文商标:TYVYT®;贝伐珠单抗生物类似药,商品名:达攸同®,英文商标:BYVASDA® ;阿达木单抗生物类似药,商品名:苏立信®,英文商标:SULINNO® ;利妥昔单抗生物类似药,商品名:达伯华®,英文商标:HALPRYZA®; 佩米替尼片,商品名:达伯坦®,英文商标:PEMAZYRE®; 奥雷巴替尼片,商品名:耐立克®; 雷莫西尤单抗,商品名:希冉择®,英文商标:CYRAMZA®;塞普替尼胶囊)获得批准上市,2个品种在NMPA审评中,4个新药分子进入III期或关键性临床研究,另外还有21个新药品种已进入临床研究。
信达生物已组建了一支具有国际先进水平的高端生物药开发、产业化人才团队,包括众多海归专家,并与美国礼来制药、赛诺菲、Adimab、Incyte和MD Anderson 癌症中心等国际合作方达成战略合作。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。
详情请访问公司网站:www.innoventbio.com或公司领英账号:Innovent Biologics。
前瞻性声明
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用“预期”、“相信”、“预测”、“期望”、“打算”及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27618
27618

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15502
15502

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14957
14957