 产业资讯
产业资讯
 bioSeedin柏思荟
bioSeedin柏思荟
 2023.03.17
2023.03.17
 1046
1046
2023年3月14日,CDE正式发布《单臂临床试验用于支持抗肿瘤药上市申请的适用性技术指导原则》,该《指导原则》最早于2022年6月20日公开征求各界意见。
通常情况下,随机对照试验(randomized controlled trial, RCT)才是临床试验的金标准,但单臂试验(single arm trial, SAT)可以减少样本量,也可缩短疗效评价时间,显著缩短了临床研发时间。
对于大多数罹患晚期恶性肿瘤的患者而言,在缺乏有效治疗手段的情况下,生存期较短,必须尽早获得可能有效的新治疗机会。
01 指导原则亮点解读
1. 单臂临床试验设计的适用性:
《指导原则》中明确提出,本指导原则仅适用于抗肿瘤治疗性药物,不包含细胞治疗和基因治疗产品。
目前,《指导原则》给出了6条可采用SAT支持药物上市的适用条件,但同时指出所有条件均非充分条件,药物上市是综合获益风险比、临床价值证明等多重因素合理判断的结果。

2.确证性临床试验如何开展?
通常情况下,依据SAT上市的药物为“附条件批准”,在上市之后仍需进行确证性试验,以证明药物长期应用的效果。
确证性试验原则上应为RCT,但《指导原则》也接受SAT作为确证性临床试验的申请:可在相同人群中开另一项SAT 作为确证性临床试验;或在同一 SAT 中继续扩展。
作为确证性临床试验的 SAT,其样本量通常不能低于支持附条件上市申请的 SAT,且通常需要提供更长随访时间的有效性数据,以表明患者的生存获益。
3.如何通过SAT申请上市?
《指导原则》给出了多个方面的要求,但指出:支持药物最终上市的,不仅仅是有效性,而是对药物的获益风险评估。
对药物在目标人群中获益风险特征的评价,是评估药物能否上市的基础;
通常采取缓解率作为主要终点,但需要关注缓解的“质量”,即产生应答的患者是否有望转化为生存获益;
在计划以 SAT 支持药物上市申请时,所获得的单药安全性数据应该能表征其基本的安全性特性;
原则上,联合治疗的关键研究不接受单臂试验设计。
02 FDA的SAT与加速审批
最典型的依据SAT予以批准的监管决策模式就是FDA的加速审评政策(Accelerated Approval,AA),允许对比现有疗法疗效优异的药物基于临床获益的替代终点加速审批,并于上市后继续研究确证其疗效。
根据FDA药品评价和研究中心在JAMA Oncology发表的文章Use of Single-Arm Trials for US Food and Drug Administration Drug Approval in Oncology, 2002-2021,2002-2021年FDA肿瘤疾病办公室批准了563项新适应症,其中176项(31%)基于SAT。
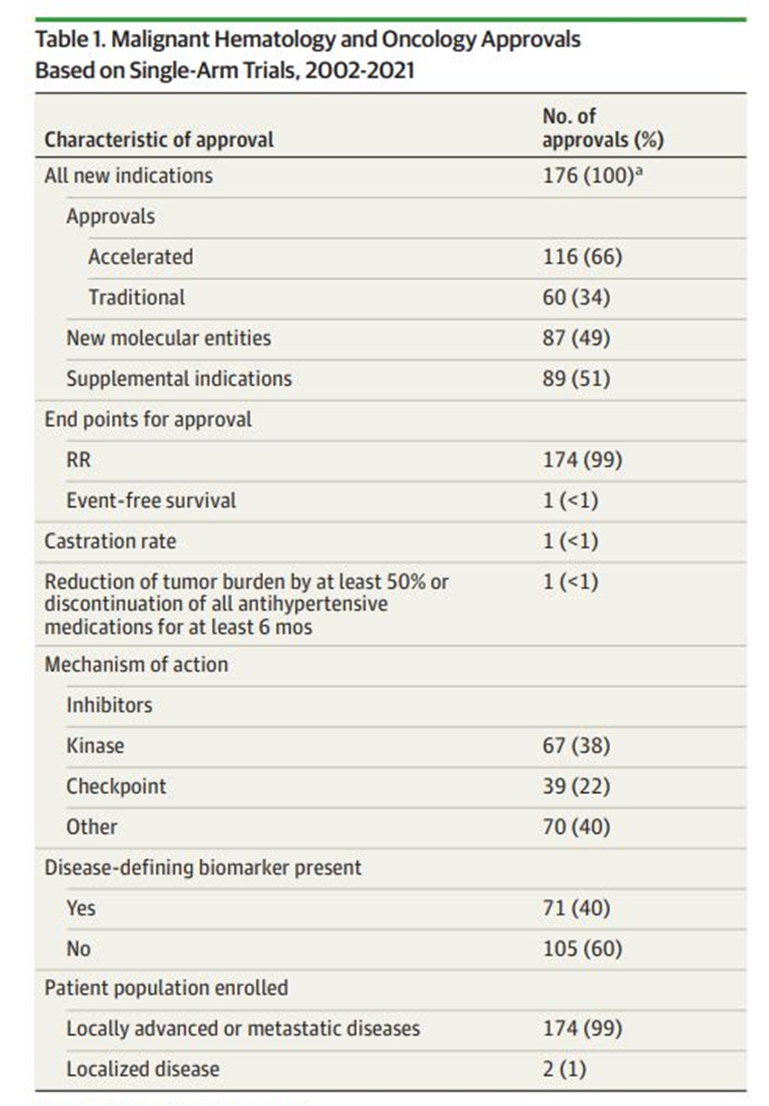
doi:10.1001/jamaoncol.2022.5985
缓解率(RR)是用于支持SAT批准的最常见终点(173/176,98%),这与《指导原则》给出的建议一致。

03 SAT的局限性
《指导原则》中明确提示了SAT的局限性之一是缓解率与生存获益之间相关性的不确定:SAT 以 ORR(客观缓解率) 为主要终点,往往只能反映药物的药效学作用,难以反映最终的获益风险特征。

2014年起,陆续有多款PI3K抑制剂基于单臂试验经由FDA加速审批通道获批上市,然而在上市后的6项RCT确证性试验中,均展示总生存期(OS)损害。
因此,2022年4月22日,FDA肿瘤药物咨询委员会以16票赞成:0票反对,1票弃权的压倒性结果,一致认为未来PI3K抑制剂在血液肿瘤中的适应症批准,需要基于随机试验数据。
此外,上述论文中显示:在基于SAT批准的176项适应症中,116项(66%)为加速批准(AA),60项例(34%)为传统批准(TA)。
但是在116项AA中,只有45项(38%)满足上市后验证临床获益的要求并转化为TA, 61项(52%)正在等待获益验证,10项(9%)已退出市场。
这也正是FDA加速审评政策近年来被诟病的原因:对确证性临床试验约束力低,药物撤市机制不完善。
代表性案例之一为Covis旗下的预防早产药物Makena:从2011年2月首次加速审批上市,再到2023年3月最终提交撤回申请,Makena及其仿制药已经在市场上流通了长达12年之久。
小结
截至2021年12月31日,我国已有48个药物附条件批准上市,其中抗肿瘤药物占75%、新冠药物占11%。已有5个品种转为完全批准,转化率为10.41%。
《指导原则》的发布对许多许多创新药企来说当然是好事,但如何确保后续获益,监管机构或许还有很长的探索道路。
参考资料:
1.CDE官网
2.FDA官网
3.Agrawal S, Arora S, Amiri-Kordestani L, et al. Use of Single-Arm Trials for US Food and Drug Administration Drug Approval in Oncology, 2002-2021 [published online ahead of print, 2022 Dec 29]. JAMA Oncol. 2022;10.1001/jamaoncol.2022.5985. doi:10.1001/jamaoncol.2022.5985

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49691
49691

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34715
34715


 2014.03.11
2014.03.11
 31125
31125