 会员动态
会员动态
 医药观澜
医药观澜
 2023.06.27
2023.06.27
 1066
1066
今日(6月26日),中国国家药监局(NMPA)官网最新公示,恒瑞医药的CDK4/6抑制剂达尔西利的新适应症上市申请已正式获批。根据恒瑞医药早前发布的新闻稿,此次获批的适应症为:联合芳香化酶抑制剂作为初始治疗,适用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性局部晚期或转移性乳腺癌患者。


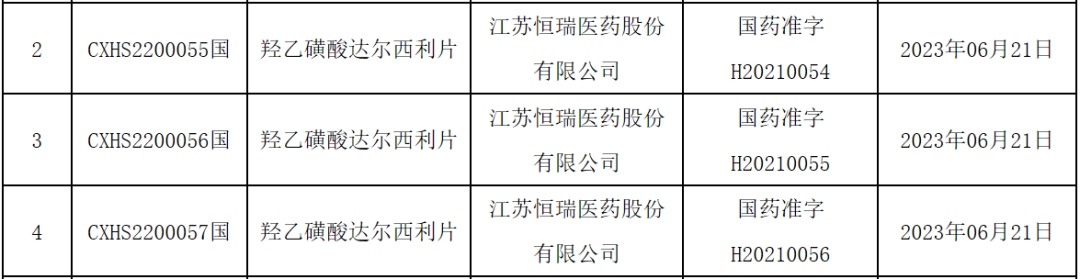
截图来源:NMPA官网
CDK4/6全称为细胞周期蛋白依赖性激酶4和6,它是驱动细胞分裂的关键调节因子。研究发现,CDK4/6在许多癌细胞中呈现过表达的现象,进而过度磷酸化和抑制Rb蛋白,导致癌细胞无序增殖。临床研究证实,超过一半的乳腺癌患者会过表达细胞周期蛋白D,且大部分为雌激素受体阳性乳腺癌患者。由于细胞周期蛋白D直接作用于CDK4/6,因此CDK4/6已成为HR阳性转移性乳腺癌患者的重要分子靶点。
达尔西利(SHR6390,dalpiciclib)是恒瑞医药研发的一款口服、高效、选择性小分子CDK4/6抑制剂。它能够选择性地抑制CDK4/6激酶活性,进而阻断CDK4/6-Rb信号通路,诱导细胞G1期的阻滞并选择性地抑制Rb高表达肿瘤细胞的增殖,从而达到抗肿瘤的作用。此外,该产品通过经典电子等排体替换引入哌啶结构,从而避免了潜在的肝脏毒性。2022年1月,达尔西利首次在中国获批上市,联合氟维司群用于治疗HR阳性、HER2阴性、经内分泌治疗后进展的复发或转移性乳腺癌。
2022年10月,恒瑞医药宣布达尔西利的新适应症上市申请获中国国家药监局药品审评中心(CDE)受理,拟用于HR阳性、HER2阴性晚期乳腺癌一线治疗。此次获批的正是该项新适应症。根据恒瑞医药早前发布的新闻稿,该新适应症上市申请是基于一项多中心、随机、对照、双盲的3期DAWNA-2研究结果。这项研究由中国医学科学院肿瘤医院徐兵河院士担任主要研究者,在中国42家中心共入组456例受试者。
根据2023年5月在《柳叶刀·肿瘤学》发表的数据,DAWNA-2研究在期中分析时达到其主要终点。达尔西利联合芳香化酶抑制剂来曲唑/阿那曲唑的中位无进展生存期(PFS)为30.6个月(vs 安慰剂组18.2个月),达尔西利联合治疗延长了12.4个月的PFS,降低疾病进展或死亡风险49%。研究者评估的PFS与独立影像评估委员会(IRC)评估的PFS相似(NR vs 22.5个月)。除了无病间期在24个月及以下的患者,达尔西利联合治疗在其余所有亚组中获得的PFS获益趋势与总人群一致。在占比约60%的内脏转移患者中,达尔西利降低患者的疾病进展或死亡风险37%。安全性方面,达尔西利总体耐受性良好,不良反应可控,未发现新的安全信号。
希望此次达尔西利新适应症在中国获批,能够为更多乳腺癌患者带来临床获益。
参考资料:
[1]2023年06月26日药品批准证明文件送达信息发布 . Retrieved Jun 26, 2023, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20230626133635185.html
[2]恒瑞医药创新药达尔西利新适应症上市申请获受理,拟用于HR+/HER2-晚期乳腺癌一线治疗. Retrieved Oct 20, 2022. From https://mp.weixin.qq.com/s/W-woBFHASh2we9SiZCzGIw
[3]喜讯!恒瑞创新药达尔西利乳腺癌研究成果荣登《柳叶刀 · 肿瘤学》. Retrieved May 13 , 2023. From https://mp.weixin.qq.com/s/jZjafj5aXmk1YE3TIZWf5g

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27661
27661

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15541
15541

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14987
14987