 研发追踪
研发追踪
 医药魔方
医药魔方
 2023.07.10
2023.07.10
 1715
1715
7月6日,FDA官网显示卫材/渤健联合开发的lecanemab(商品名:Leqembi)用于治疗阿尔茨海默症(AD)的加速批准已成功转为完全批准。这也意味着lecanemab成为了20年来首款获得FDA完全批准的AD新疗法。

Lecanemab是一种抗β淀粉样蛋白(Aβ)单克隆抗体,可以选择性中和并清除导致阿尔茨海默病神经病变的可溶且有毒性的Aβ聚集体。因此,lecanemab可能对AD病理过程产生积极影响并减缓疾病发展进程。卫材和渤健共同负责该产品的开发和商业化,且卫材拥有最终决策权。
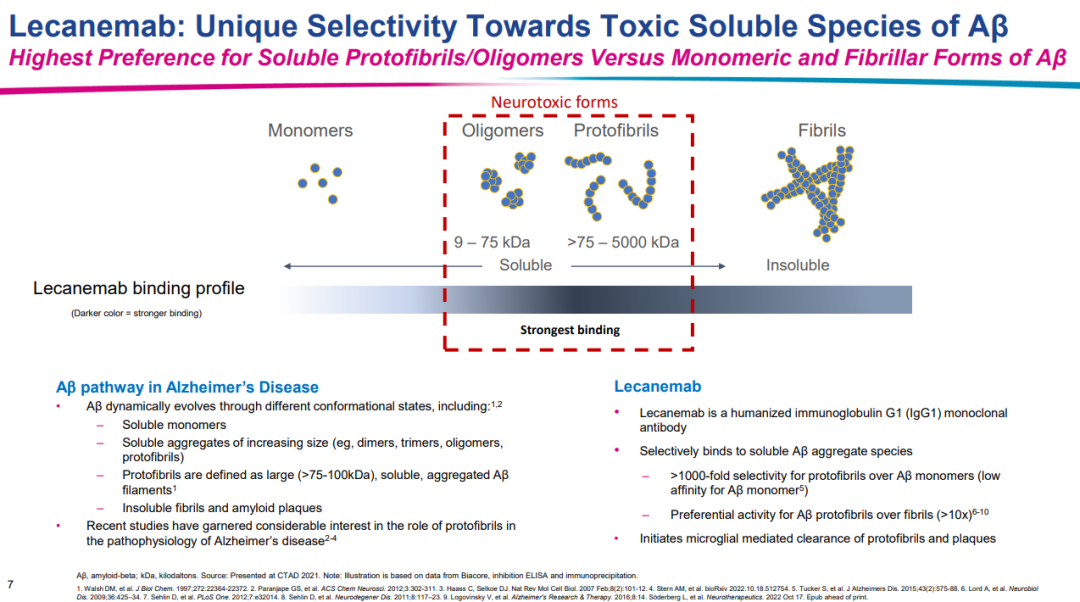
1月6日,基于IIb期概念验证性临床试验 (BAN2401-G000-201) 结果,FDA在加速审批途径下批准了lecanemab治疗AD的上市申请。不过,只有在轻度认知障碍或轻度痴呆阶段且在病理学上确认存在Aβ的AD患者中才能进行lecanemab治疗。在lecanemab获得加速批准的同一天,卫材向FDA提交了寻求lecanemab全面批准的sBLA。此次申请是基于验证性III期Clarity AD研究的积极结果,试验达到了主要终点和所有关键次要终点,且结果具有高度统计学意义。
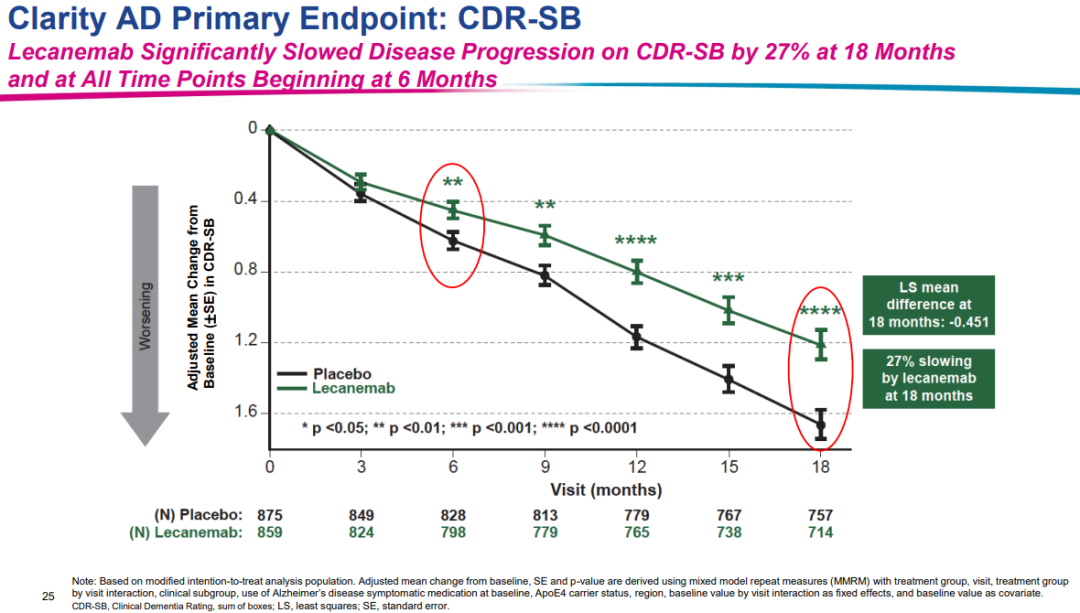
6月10日,在FDA外周和中枢神经系统药物咨询委员会上,与会专家以6:0的投票结果一致支持lecanemab基于III期CLARITY AD研究的积极结果获得完全批准。目前,lecanemab的定价为2.65万美元/年。美国医保方(CMS)曾表态在lecanemab全面批准时可能会考虑扩大覆盖范围。

值得一提的是,lecanemab在中国的上市申请已于2022年12月获CDE受理。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34416
34416

 医药地理
医药地理
 2018.10.22
2018.10.22
 18852
18852

 医谷
医谷
 2019.03.18
2019.03.18
 18817
18817