 医改专题
医改专题
 中国医疗保险
中国医疗保险
 2023.10.18
2023.10.18
 991
991
一、研究背景
长期以来,药品价格虚高问题严重,患者医药费用负担沉重[1]。为引导药品价格回归合理水平,切实减轻患者负担,营造风清气正的医药流通环境,按照党中央、国务院决策部署,国家医保局于2018年组织4个直辖市和7个副省级城市开展药品集中采购试点[2],推动仿制药与原研药同台竞争[3]。为确保中选药品质量,集采以通过仿制药质量和疗效一致性评价为门槛,要求仿制药与原研药或参比试剂实现生物等效。中选企业能否始终保障药品质量和供应,需要跟踪监测评估,国家医保局联合国家卫生健康委等有关部门出台了一系列政策及举措,要求保障集采中选药品的配备和合理使用,特别要做好集采中选药品临床使用情况监测,建立健全药品临床使用监测网络和评价体系[4]。集采药品大幅降价后,少数医疗从业人员及民众对使用低价中选药品存在顾虑,对中选仿制药的质量存在质疑和观望。因此,对集采中选仿制药进行真实世界研究有助于评价其在实际临床应用中的有效性和安全性,这是上市前临床研究和随机对照试验所不能代替的[5,6],不仅可以支持政府决策,还有助于打消医生和患者对中选仿制药的质疑,更好推动政策落地实施。
基于此,国家医保局于2019年设立第一批集采中选药品疗效与安全性评价的真实世界研究课题,由首都医科大学宣武医院牵头北京市20家特色明显的医疗机构整理得到集采中选仿制药疗效和安全性评价真实世界研究数据,评价了14个慢性病和重大专科疾病治疗药物[7,8]。课题结果显示,集采中选仿制药疗效和安全性与原研药无统计学差异,为临床合理用药提供了循证依据。
随着国家组织药品集采常态化制度化推进,更多药品纳入了集采范围,为进一步研究新批次集采中选药品疗效和安全性,2021年8月国家医保局委托宣武医院牵头启动了针对第二、三批集采中选药品的临床疗效和安全性真实世界评价研究。参与此次研究的医疗机构扩大到全国16个省份29家医院,药物涉及抗感染、抗肿瘤、代谢及内分泌、心脑血管、神经精神、消化系统等6大治疗领域的23个品种。
二、研究目的
(一)比较集采中选仿制药和原研药在主要疾病治疗领域中对主要临床结局指标的影响差异,促进集采中选药品临床合理使用;
(二)推动临床疗效安全性相当、价格合理、成本效果比更有优势的药品进入一线医务人员和患者的优先选择范围,为国家组织集中采购政策实施与完善提供科学、客观、有价值的循证医学证据;
(三)进一步探索并完善集采中选药品真实世界药品使用和评价体系,为常态化集采中选药品综合评价提供技术支撑和积累实践经验。
三、研究内容与研究方法
本研究主要关注第二、三批国家组织集中采购中选药品在临床真实诊疗环境中的疗效和安全性。本次评价联合了全国16个省及直辖市共计29家特色明显的医疗机构,覆盖心血管、抗肿瘤、神经精神疾病、抗感染、代谢及内分泌和消化系统6大类,涉及23个品种(表1)。
(一)数据来源及患者具体信息采集
从参加本次研究的29家医疗机构的病历数据中,提取研究药物治疗及临床结局相关的基线资料及研究指标,用于有效、安全及经济性评价,主要信息包括:
1.就诊信息:就诊时间、科室、诊断等。
2.患者人口统计学特征:性别、年龄、民族、医保类型、婚育情况等。
3.生命体征:呼吸、心率、体温、血压等。
4.既往病史与过敏史:既往手术史、慢病及治疗用药情况、药物及食物过敏史等。
5.现病史及治疗史:发病时间、既往就诊情况、确诊依据和时间、临床症状/体征、实验室检查、辅助检查等。
6.处方情况:处方药物名称、处方天数、用法用量(剂量/次、次数/天、用药天数等)、合并用药情况等。
7.治疗结局:住院天数、治疗天数、结局相关的临床症状/体征、实验室检查、辅助检查等。
8.安全性信息:药物不良反应信息,包括开始时间、症状/体征、严重程度、临床处理、结局、关联性判断等。相关不良反应实验室检查等。
9.经济学指标:药品成本、诊疗成本等。
(二)数据纳入和排除标准
纳入标准:
1.研究期间内使用研究药物的患者(包括集采中选仿制药和原研药);
2.若限定研究药物具体的适应症,则纳入临床诊断符合该适应症的患者;
排除标准:
排除病例资料不全、目标结局不可追溯的患者。
(三)统计学方法
1.组间基线校正
为了减少数据偏差和混杂变量影响,采用倾向性评分匹配法(propensity score matching,PSM)均衡组间协变量后,对比集采中选仿制药和原研药的有效性、安全性及经济性等结局指标。该模型基于年龄、性别、医保类型、诊断及研究药物相关基线指标为协变量,倾向性匹配按1:1~4最邻近匹配法、匹配容差0.02~1进行匹配。
2.结局指标分析方法
计量资料以均数±标准差(MEAN±SD)表示,组间比用t检验、Wilcoxon秩和检验、方差及协方差分析处理;分类变量用例数/百分比(n/%)表示,组间比用χ2检验处理。假设检验统一使用双侧检验,双侧检验的P值小于0.05被认为有统计学意义。
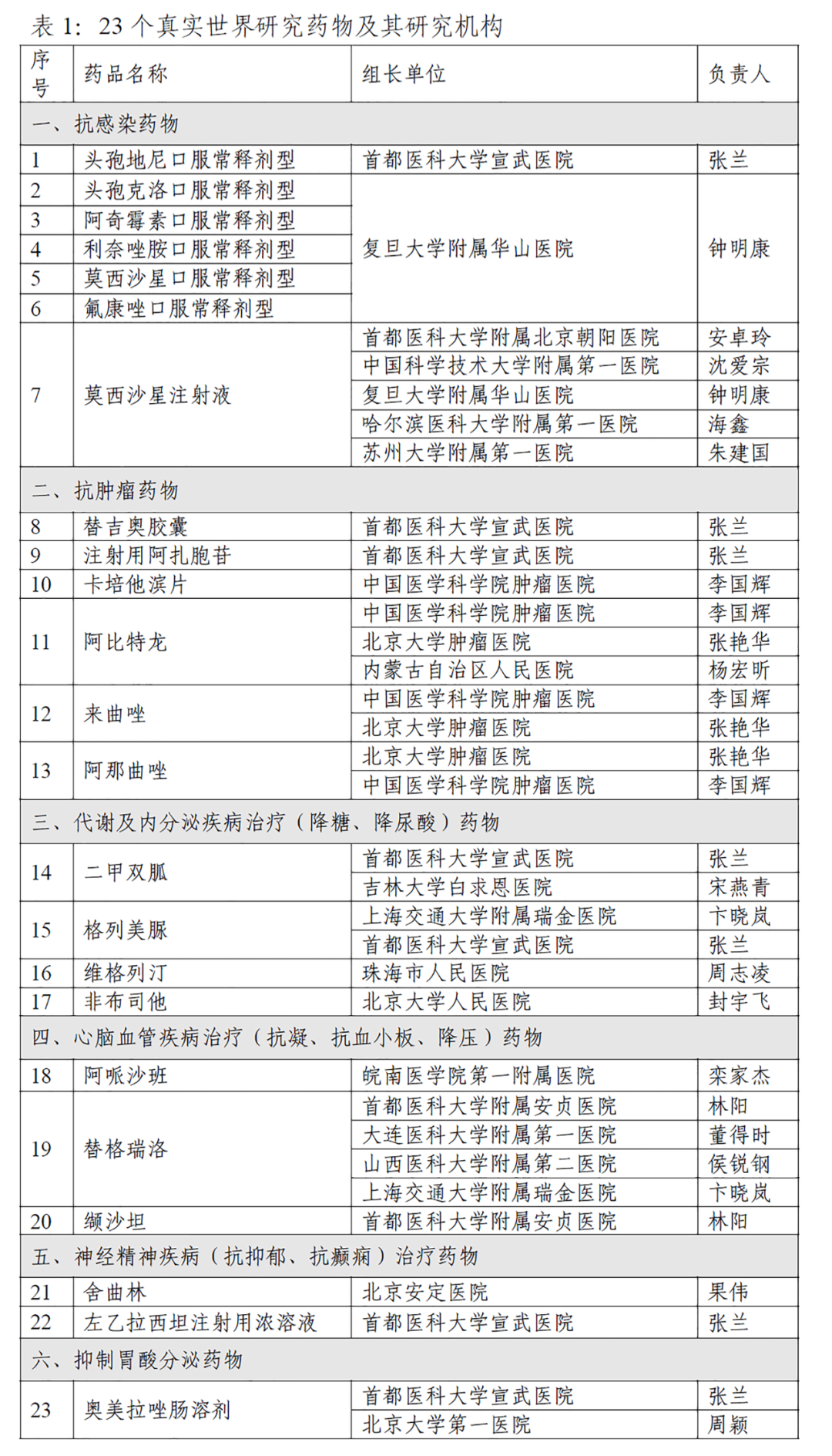
(四)参与医疗机构
参与真实世界研究的29个医疗机构分别是:首都医科大学宣武医院、中国医学科学院肿瘤医院、北京大学第一医院、北京大学人民医院、北京大学肿瘤医院、北京安定医院、首都医科大学附属北京朝阳医院、首都医科大学附属安贞医院、天津医科大学总医院、山西医科大学附属第二医院、内蒙古自治区人民医院、大连医科大学附属第一医院、吉林大学白求恩医院、哈尔滨医科大学附属第一医院、复旦大学附属华山医院、上海交通大学附属瑞金医院、苏州大学附属第一医院、中国科学技术大学附属第一医院、皖南医学院第一附属医院、青岛大学附属医院、河南省人民医院、珠海市人民医院、广东省人民医院、南部战区总医院、江门市中心医院、中山市人民医院、云南省肿瘤医院、西安交通大学附属第一医院、青海省人民医院。
四、结果
(一)抗感染治疗药物(7个品种)疗效和安全性评价
1. 门诊患者抗感染药物使用情况
由国家传染病医学中心复旦大学附属华山医院与国家老年疾病临床医学研究中心首都医科大学宣武医院牵头开展,纳入5种在门诊使用的口服抗感染药物,包括:头孢地尼分散片、头孢克洛胶囊、阿奇霉素片、莫西沙星片、氟康唑胶囊/片。研究收集了58004例感染患者门诊处方数据,PSM匹配后,纳入基线一致的22536例感染患者数据进行统计分析,以保证仿制药组与原研药组的可比性。
有效性方面,主要采用抗感染处方疗程、仿制药和原研药间相互换药率等间接指标反映疗效;对于指南推荐疗程较长的氟康唑,还考察了持续治疗率;头孢地尼还观察了白细胞计数、中性粒细胞百分数改善情况。
结果显示,5种仿制药组换药率与原研药组相当或更低。阿奇霉素片和莫西沙星片仿制药和原研药疗程相当;受包装规格影响,头孢地尼分散片和头孢克洛胶囊仿制药组疗程略长于原研药组,但均符合细菌感染常规治疗疗程。头孢地尼仿制药组患者处方前、后白细胞计数及中性粒细胞百分数显著下降至正常范围区间,疗效明确。
根据指南推荐,氟康唑口服常释剂型治疗真菌感染的理论疗程平均值约为58.8天。集采仿制药和原研药的疗程天数均在临床指南推荐范围内,仿制药组的处方疗程(32-35天)和持续治疗率(25-27%)均大于原研药组(14-15天,11-12%),这可能是因为中选仿制药降价后,患者的依从性更好。
安全性方面,头孢克洛胶囊、阿奇霉素片、莫西沙星片和氟康唑口服常释剂型仿制药组合并保肝药处方患者比例与原研药组相当或低于原研药组,两组间抗组胺药、质子泵抑制剂及胃黏膜保护药使用比例无差异。头孢地尼集采仿制药组和原研药组处方前、后肝功能和肾功能相关指标(如:转氨酶、胆红素、血肌酐等)无统计学差异,未收集到集采仿制药头孢地尼的药品不良反应报告。
2. 住院患者抗感染药物使用情况
莫西沙星注射液集采仿制药评价的数据来自国家传染病医学中心复旦大学附属华山医院、首都医科大学附属北京朝阳医院、苏州大学附属第一医院、中国科学技术大学附属第一医院(安徽省立医院)、哈尔滨医科大学附属第一医院及皖南医学院第一附属医院(弋矶山医院)6家医疗机构,共4021例使用莫西沙星注射液的住院患者。对患者基本情况等基线资料进行PSM匹配后,纳入统计分析的病例数为2643例。
结果显示,莫西沙星注射液仿制药组与原研药组在抗感染治疗有效率、白细胞计数、中性粒细胞百分数、C反应蛋白水平、降钙素原水平、感染患者体征改善率、体温控制率、体温恢复时间、病原菌清除率等指标均无统计学差异。
5个中心的安全性评价结果显示,莫西沙星注射液集采仿制药组药品不良反应上报率与原研药组相当或低于原研药组,差异无统计学意义;各组间肝功能检查(转氨酶、胆红素)变化水平及肝功能异常患者比例无统计学差异。
但是,我们发现,其中一个中心的莫西沙星注射液集采仿制药组的不良反应(均为一般性不良反应)上报率高于原研药组(7.3% VS 2.6%),差异有统计学意义。
利奈唑胺片评价研究由国家传染病医学中心复旦大学附属华山医院牵头,河南省人民医院参与。采集了住院期间使用利奈唑胺片治疗的310例患者,PSM匹配后,集采仿制药组60例,原研药组35例。两组抗感染治疗的临床有效率均>80%,无统计学差异;两组联合使用其他抗菌药物情况、抗感染治疗疗程均无统计学差异。
安全性方面,3名使用利奈唑胺原研药患者治疗期间出现肝功能损伤,未观察到利奈唑胺集采仿制药组患者出现肝功能损伤;两组治疗期间及停药3天内合用保肝药、抗组胺药、质子泵抑制剂及胃黏膜保护药患者的比例无统计学差异。在血细胞三系降低、恶心呕吐、皮疹以及腹泻等不良反应方面,两组无统计学差异。
(二)抗肿瘤药物(6个品种)疗效和安全性评价
1. 泌尿生殖系统肿瘤
由国家癌症中心中国医学科学院肿瘤医院、北京大学肿瘤医院和内蒙古人民医院3家医疗机构牵头,对集采中选仿制药醋酸阿比特龙片进行评价。研究入组675例前列腺癌患者,符合纳排标准且基线一致的患者437例。以治疗后前列腺特异性抗原(PSA)水平下降程度作为疗效指标。醋酸阿比特龙仿制药治疗后PSA水平显著降低,PSA 50%缓解率和原研药组相比,无统计学差异。
阿比特龙仿制药组不良反应发生率与原研药组相比无统计学差异。本研究中出现3级以上不良反应患者共4例,其中原研药组3例(1例肝功能损害、1例重度低钾、1例重度高血压),仿制药组1例(1例肝功能损害)。
2. 乳腺系统肿瘤
由国家癌症中心中国医学科学院肿瘤医院、北京大学肿瘤医院牵头,对来曲唑片和阿那曲唑片进行疗效和安全性评价。累计纳入绝经后早期乳腺癌患者673例。
结果显示,来曲唑仿制药和原研组患者在15个月的观察期内均未发生肿瘤转移或复发。长期随访发现,集采仿制药组患者5年无病生存率为96.7%,原研药组5年无病生存率为89.4%,总体预后良好,组间无统计学差异。
阿那曲唑仿制药和原研药组患者在最长15个月的观察期内均未发生转移或复发;长期随访发现,大部分患者存在不同厂家药品穿插交替使用的情况。在仅使用阿那曲唑集采仿制药和原研药治疗的患者中,原研药组和仿制药组均有1例患者复发。
安全性方面,来曲唑集采仿制药组和原研药组在血脂异常、肝功能异常发生率等指标上无统计学差异。阿那曲唑集采仿制药和原研药在血脂异常、肝功能异常、骨质疏松发生率等指标上无统计学差异。
3. 消化系统肿瘤
由国家癌症中心中国医学科学院肿瘤医院、首都医科大学宣武医院牵头,云南省肿瘤医院、皖南医学院第一附属医院(弋矶山医院)参与评价,纳入替吉奥胶囊和卡培他滨片两个品种,共纳入1012例住院治疗胃癌和肠癌患者。
替吉奥胶囊集采仿制药组和原研药组在中位无进展生存时间、复发率、转移率、糖类抗原CA19-9、CA72-4、癌胚抗原CEA的水平和达标率均无统计学差异。
使用卡培他滨片集采仿制药一线治疗胃、肠癌的患者,完全缓解率(CR)和部分缓解率(PR)略高于原研药组,差异有统计学意义(P=0.009);两组的客观缓解率(ORR)和疾病控制率无统计学差异。
安全性方面,替吉奥胶囊集采仿制药和原研药不良反应发生率和药品不良反应相关停药率均无统计学差异。卡培他滨片集采仿制药组和原研药组的血液系统、肝肾功能、消化系统及手足综合征等主要不良反应发生率均无统计学差异。
4. 血液系统肿瘤
研究纳入了首都医科大学宣武医院和皖南医学院第一附属医院(弋矶山医院)住院使用阿扎胞苷治疗骨髓增生异常综合征、急性髓系白血病和慢性粒-单核细胞白血病患者116例。结果显示,阿扎胞苷集采仿制药组和原研药组治疗2个疗程的缓解率分别为59.4%和52.6%,无统计学差异。
安全性方面,患者在使用含阿扎胞苷的化疗方案治疗期间发生的不良反应主要包括骨髓抑制、继发感染、胃肠道反应、肝功能损伤、发热、乏力等。仿制药组和原研药组患者的不良反应发生率无统计学差异。
(三)代谢及内分泌疾病治疗药物(4个品种)疗效和安全性评价
1. 降糖药
由国家代谢性疾病临床医学研究中心上海交通大学医学院附属瑞金医院、国家老年疾病临床医学研究中心首都医科大学宣武医院牵头,联合吉林大学白求恩医院、珠海市人民医院、皖南医学院第一附属医院(弋矶山医院)、河南省人民医院、中山市人民医院、江门市中心医院、中国人民解放军南部战区总医院共9家中心,采集了二甲双胍片、格列美脲片、维格列汀片3种口服降糖药共23763的门诊病例的23763例次患者进行研究。对口服上述三种降糖药的2型糖尿病患者相关数据,经过PSM匹配后,纳入可获取疗效相关结局指标(有治疗前、后相关实验室检查数据)的1323例患者。
结果显示,二甲双胍片、格列美脲片集采仿制药和原研药均能有效降低FPG、HbA1c,仿制药组和原研药组3个月随访期内HbA1c达标率、FPG达标率相当,无统计学差异。维格列汀片集采仿制药治疗后可使HbA1c平均下降0.7%,FPG平均下降1.33mmol/L,与原研药组相比无统计学差异。
安全性方面,二甲双胍片、格列美脲片集采仿制药治疗后,肝、肾功能异常的发生率和原研药组相比均无统计学差异;19252例使用二甲双胍片和格列美脲片的患者在研究期间均未收集到相关的药品不良反应报告。4511例使用维格列汀片的患者共收到9例一般不良反应报告,其中集采仿制药组和原研药组不良反应上报率分别为0.16%和0.27%,低血糖发生率分别为6.6%和6.8%,组间无统计学差异。
2. 降尿酸药
数据来自就诊于北京大学人民医院、北京清华长庚医院和首都医科大学附属北京朝阳医院,处方非布司他的9858名痛风伴高尿酸血症患者。采用尿酸控制达标率(SUA<300 µmol/L)、药物治疗2周、4周、12周、24周及48周血尿酸降低百分率作为疗效指标。经严格纳排及PSM匹配后,最终304名患者纳入分析。
结果显示,非布司他集采仿制药和原研药两组的疗效指标均无统计学差异,有效性相当。
在安全性评价中,9858名非布司他集采仿制药组和原研药组肝功能异常的发生率分别为1.7%和3.0%,差异无统计学意义;两组均未观察到非布司他相关恶心、头痛、皮疹等不良反应的相关病例记录。
(四)心脑血管疾病治疗药物(3个品种)疗效和安全性评价
1. 抗血小板药
替格瑞洛是直接口服抗血小板药物,用于预防及降低急性冠脉综合征(ACS)的患者血栓发生风险。由国家心血管疾病临床医学研究中心首都医科大学附属北京安贞医院牵头,联合大连医科大学附属第一医院、山西医科大学第二医院、上海交通大学医学院附属瑞金医院、广东省人民医院、珠海市人民医院、皖南医学院第一附属医院(弋矶山医院)、西安交通大学附属第一医院8家医疗机构对替格瑞洛片进行有效性和安全性评价。研究采集了门诊及住院使用替格瑞洛片治疗急性冠状动脉综合征(ACS)的10873例次患者信息,经过纳排及PSM匹配,纳入了3528例患者,以治疗期间主要心血管事件(MACE)发生率、替格瑞洛治疗后血小板最大聚集率和达标率作为有效性评价指标。结果显示,替格瑞洛集采仿制药组和原研药组的上述指标均无统计学差异。
安全性方面,替格瑞洛集采仿制药组和原研药组在主要出血事件发生率和其他出血事件(包括非致命的消化道出血、咯血、牙龈出血、皮肤瘀斑等)发生率均无统计学差异。
2. 抗凝药
阿哌沙班是直接作用于凝血因子的口服抗凝药,用于关节置换术后患者预防静脉血栓事件(VTE)。数据来自就诊于皖南医学院第一附属医院(弋矶山医院)、广东省人民医院、天津医科大学总医院、河南省人民医院、西安交通大学附属第一医院5家中心,行髋关节或膝关节择期置换术、术后服用阿哌沙班片治疗的成年患者共计1724例,纳入符合纳排条件的患者986例。采用预防静脉血栓栓塞症的发生及凝血功能指标评价疗效。阿哌沙班集采仿制药组和原研药组静脉血栓栓塞症发生率等指标均无统计学差异。
安全性方面,未观察到阿哌沙班集采仿制药组治疗后肝、肾功能异常发生率和原研药组间存在差异。
3. 降压药
缬沙坦是血管紧张素II受体拮抗剂(ARB)类降压药,具有良好的心肾保护作用和心血管终点事件预防作用。由国家心血管疾病临床医学研究中心首都医科大学附属北京安贞医院牵头、皖南医学院第一附属医院(弋矶山医院)、河南省人民医院参与,纳入了使用缬沙坦治疗成人原发性高血压,且随访期内行2次超声心动图检查或2次肾功能检查的患者940例,经过PSM匹配后380例患者数据纳入分析。采用缬沙坦对心、肾靶器官保护效应作为有效性和安全性评价指标,以缬沙坦治疗3个月后血肌酐(CREA)升高情况评价肾损害进展,以心脏左室射血分数降低情况评价心脏功能的下降。
结果显示,缬沙坦仿制药组治疗3个月后CREA水平变化及左室射血分数变化与原研药组相比均无统计学差异,两组对心脏和肾脏功能的保护作用相当,仿制药组疗效和安全性均与原研药组一致。
(五)神经精神疾病治疗药物(2个品种)疗效和安全性评价
1.抗抑郁药
由国家精神心理疾病临床医学研究中心首都医科大学附属北京安定医院牵头,纳入门诊处方舍曲林治疗抑郁症、强迫障碍患者36219例。采用日剂量和血药浓度作为疗效评价指标;采用肝功能、肾功能、血脂水平、泌乳素水平、换药率、二次换药率作为安全性评价指标。
舍曲林集采仿制药组和原研药组在日剂量和血药浓度指标上无具有临床意义的差异;两组肝功能、肾功能、泌乳素水平异常患者的比例及二次换药率均无统计学差异,仿制药组患者低密度脂蛋白(LDL-C)水平异常患者比例(41.75%)低于原研药组(45.39%),差异有统计学意义。
2.抗癫痫药
由国家神经疾病医学中心首都医科大学宣武医院牵头,联合皖南医学院第一附属医院(弋矶山医院),收集住院使用左乙拉西坦注射用浓溶液的517例患者数据,对基线一致的298例成人患者进行分析。采用治疗癫痫有效率、预防癫痫有效率作为疗效评价指标;采用药品不良反应上报率作为安全性评价指标。
结果显示,左乙拉西坦注射用浓溶液仿制药组和原研药组治疗癫痫有效率(66.7% vs 71.4%)及预防癫痫有效率(100% vs 98.8%)均无统计学差异;左乙拉西坦注射用浓溶液安全性较高,研究期内两组均未监测到相关不良反应报告。
(六)抑制胃酸分泌药物(1个品种)疗效和安全性评价
采集首都医科大学宣武医院和北京大学第一医院门诊诊断为消化性溃疡(PUD)和胃食管反流(GERD)等胃酸相关性疾病,并处方奥美拉唑肠溶胶囊患者4000余例。采用用药天数、药物持有率、剂量上调率、换药率等指标间接评价疗效。经过PSM匹配后,共纳入2536例患者。结果显示,奥美拉唑肠溶胶囊集采仿制药组与原研药组在上述疗效相关指标上均无统计学差异,两组在研究期间均未监测到奥美拉唑相关的不良反应报告。
五、结论
本研究覆盖了全国16个省市,29家医疗中心患者病例资料,数据收集时间范围长,大多为带量采购实施前后一年及以上,样本量较大;倾向性评分匹配消除了部分混杂偏倚,研究结果可信度较高。同时本研究也存在一些局限性:个别药品的疗效及安全性缺乏评价指标或无法获取;电子病历记录不完整可能造成某些结局指标发生率的低估;部分随访结果可能存在患者的回忆偏倚;部分药品的研究为单中心研究,研究结果外推时需要注意。
本研究从科学的角度为临床医生用药决策提供了重要的参考,为促进集采中选药品的临床合理使用、为国家组织集中采购政策的实施提供了循证支持。同时,本研究深入探索集采药品使用和疗效监测,建立相应的评价体系,为国家组织集采政策落地实施和效果评价的模式和方法提供了可借鉴的范本。
参考文献
[1] 张维斌. 虚高药价的成因及治理策略探讨[J]. 中国药房,2016,27(22):3028-3030,3031.
[2] 国务院办公厅. 关于印发国家组织药品集中采购和使用试点方案的通知(国办发[2019]2号)[EB/OL]. (2019-01-17) [2023-09-05].
https://www.gov.cn/zhengce/content/2019-01/17/content_5358604.htm
[3] 国家药监局. 关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告[EB/OL]. (2020-05-12) [2023-09-05].
https://www.gov.cn/zhengce/zhengceku/2020-05/15/content_5511902.htm.
[4] 国务院办公厅. 关于推动药品集中带量采购工作常态化制度化开展的意见(国办发[2021]2号)[EB/OL]. (2021-01-28) [2023-09-05].
http://www.gov.cn/zhengce/content/2021-01/28/content_5583305.htm.
[5] 张兰,董宪喆,王之舟.真实世界研究在国产仿制药临床疗效与安全性评价中的应用及展望[J].药物不良反应杂志,2023,25(3):129-132.
[6] 廖珊妹,张小娟,张晓薇,徐圣,苏岭.真实世界研究的方法学进展[J].中国食品药品监管,2021,(4):32-43.
[7] 韩嘉伦,张翼,林佰弟,石秀锦,赵强,王依繁,闫佳琳,林阳.中标对比原研氯吡格雷用于急性冠脉综合征患者经皮冠状动脉介入术后治疗的临床有效性及安全性研究[J].中国医院药学杂志,2021,41(6):601-605.
[8] Ying Xie, Hanqiu Zhan, Xiaohong Zhu, Yuan Li, Ruyi Tian, Jing Zhang, Shanshan Chen,Yanling Zhao. Comparison of the efficacy and adherence of generic and brand-name entecavirs in chronic hepatitis B patients: a multicenter cohort study[J]. Joumal of Chinese Pharmaceutical Sciences, 2021, 30 (12), 986-993.

 医药代表
医药代表
 2019.05.29
2019.05.29
 27041
27041

 赛柏蓝器械
赛柏蓝器械
 2018.11.21
2018.11.21
 15434
15434

 药店经理人
药店经理人
 2019.08.16
2019.08.16
 11607
11607