 研发追踪
研发追踪
 医药笔记
医药笔记
 2023.12.29
2023.12.29
 1854
1854
2023年12月26日,安进宣布FDA完成对其KRAS G12C抑制剂Sotorasib谋求完全批准sNDA的审评,FDA拒绝完全批准,要求进行额外的验证临床试验,并不晚于2028年2月完成。

2023年10月5日,FDA就安进KRAS G12C抑制剂Sotorasib的三期验证临床组织了专家委员会进行论证。
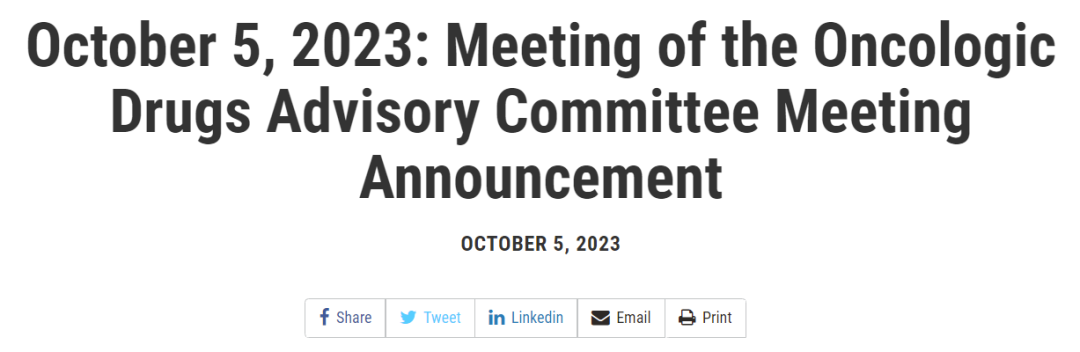
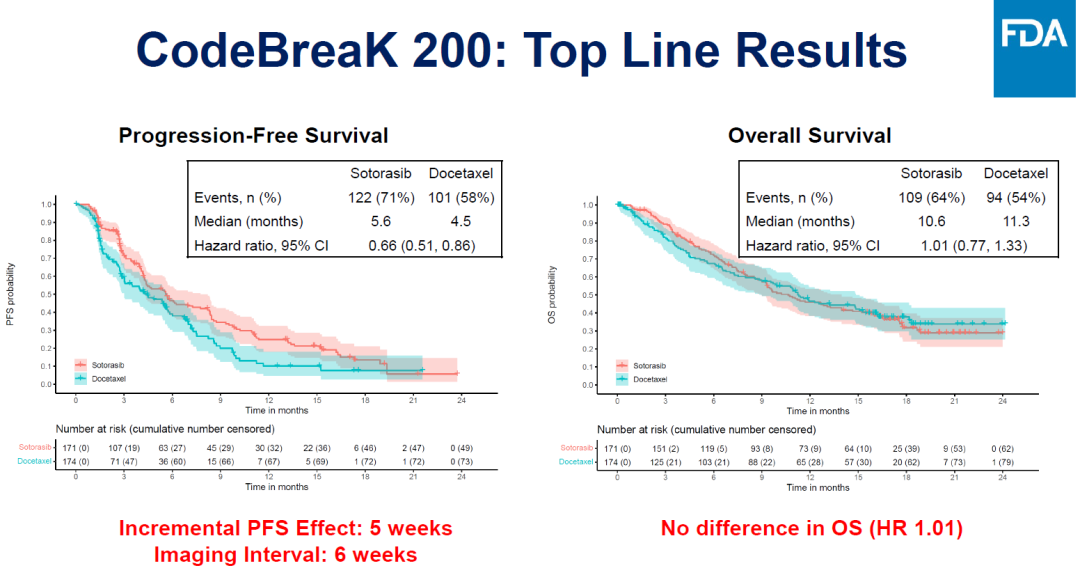
Sotorasib于2021年获得加速批准,此次讨论的是验证临床CodeBreak 200的临床数据。相比于多西他赛,Sotorasib治疗组PFS有改善,OS没有区别,总体来看主要疗效终点不明确。
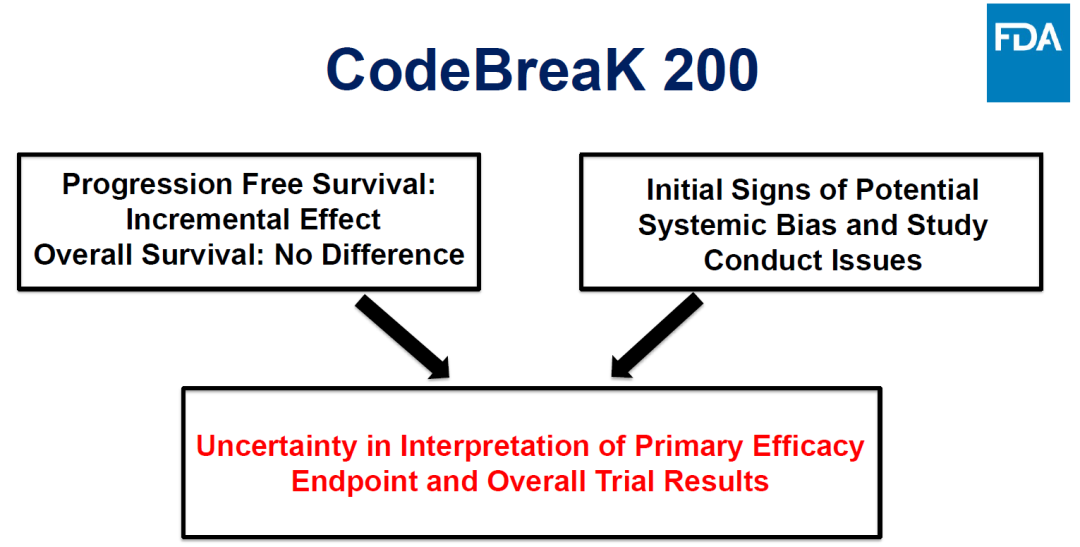
Sotorasib此前加速批准依靠的是CodeBreak 100的数据,ORR为36%,mDOR为10个月。
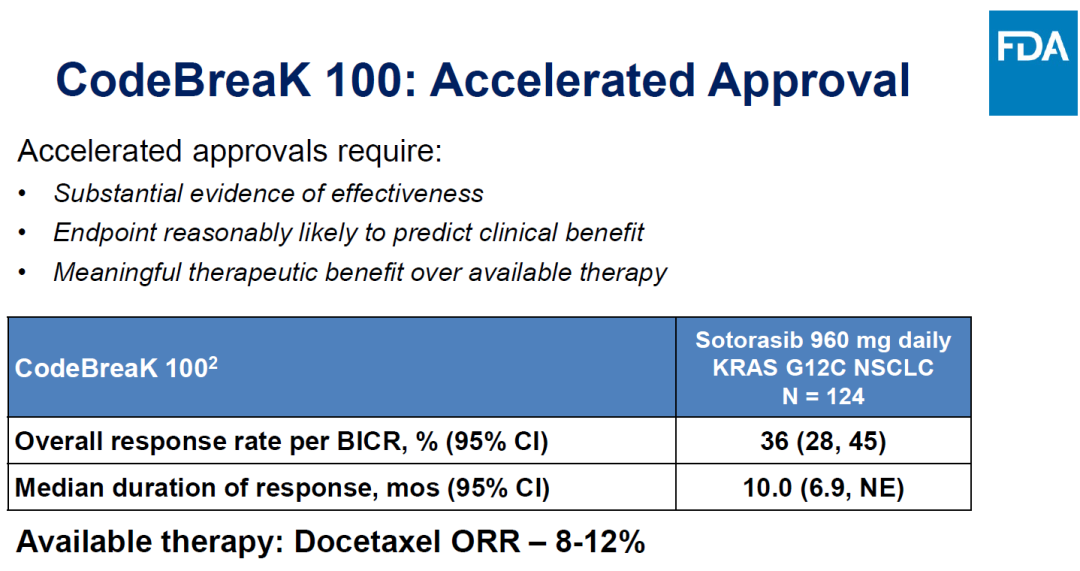
验证临床CodeBreak 200的临床设计如下。
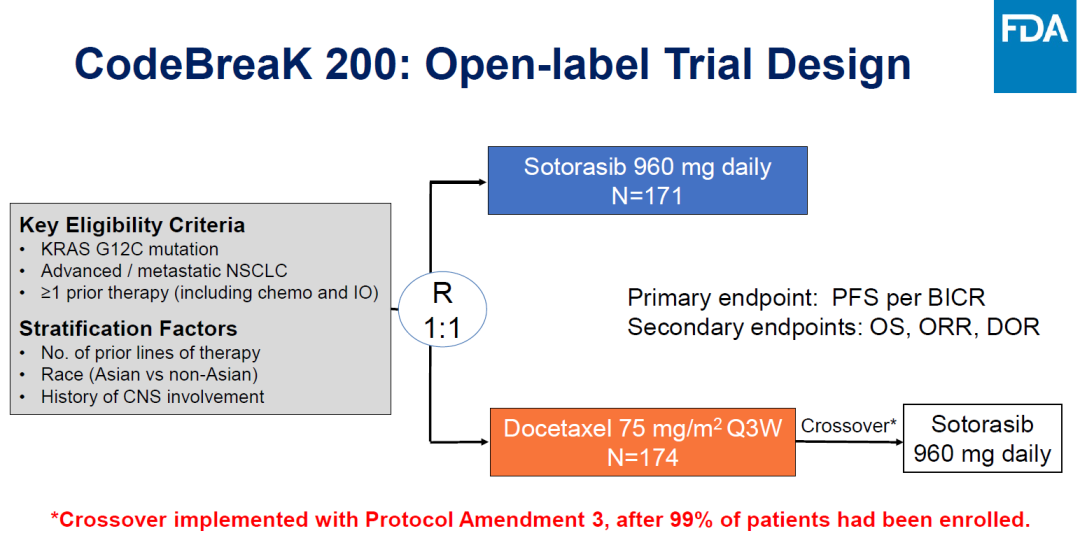
Sotorasib与多西他赛治疗组,mPFS分别为5.6个月、4.5个月,OS分别为10.6个月、11.3个月。
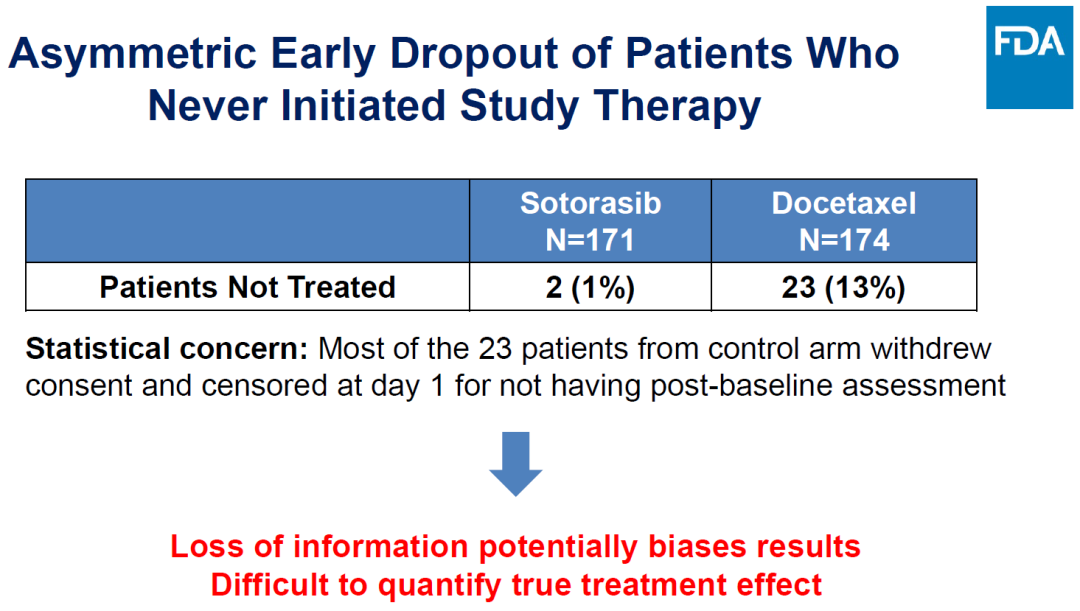
多西他赛组23例患者脱落,导致真实疗效难于评价。
FDA专家委员会认为Sotorasib的疗效能否确定是存疑的。

总结
上述审评会议上专家组最终以2票赞同,10票反对的结果,认为CodeBreaK 200的主要研究终点(盲态独立中心评估 BICR]的无进展生存期PFS无法被可靠地解释。需要注意的是,此次会议讨论的并非获益-风险评价,而是临床设计和实施的问题。因此,FDA拒绝完全批准Lumakras,并要求进行额外临床验证。须知这样的低级错误对于MNC来说,也是不太常见的,更多时候我们看到的是因为生产问题而非临床设计问题导致CRL。

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34399
34399

 医药地理
医药地理
 2018.10.22
2018.10.22
 18847
18847

 医谷
医谷
 2019.03.18
2019.03.18
 18804
18804