 研发追踪
研发追踪
 药明康德
药明康德
 2024.03.11
2024.03.11
 1178
1178
诺和诺德(Novo Nordisk)今天公布了司美格鲁肽(semaglutide)于FLOW临床3期试验的主要结果。分析显示,1.0 mg司美格鲁肽可使2型糖尿病和慢性肾病(CKD)患者发生肾病相关事件风险降低24%。根据新闻稿,大约有40%的2型糖尿病患者带有CKD,而司美格鲁肽具潜力成为这类患者的首款胰高血糖素样肽-1(GLP-1)类疗法。诺和诺德计划于2024年向美国和欧盟递交Ozempic标签扩展的监管审批申请。FLOW研究的详细结果也预计将在2024年的科学会议上发布。
FLOW临床试验是一项随机双盲、安慰剂对照的临床试验,旨在检视剂量为1.0 mg的注射型司美格鲁肽与安慰剂相比,作为标准治疗的辅助疗法,在2型糖尿病和CKD患者中预防肾损伤的进展,以及肾和心血管死亡风险的效果。该试验招募了3533名患有2型糖尿病和CKD的患者。试验主要终点为由多个部分组成的复合终点,包括:与基线相比,估计肾小球滤过率(eGFR)持续下降≥50%的出现时间;eGFR下降至<15 mL/min/1.73 m2的时间;开始慢性肾脏替代治疗(透析或肾移植);2型糖尿病和慢性肾病患者死于肾病或死于心血管疾病。关键次要终点包括eGFR的年变化率、主要不良心血管事件(非致死性心肌梗死、非致死性卒中、心血管死亡)和全因死亡。
2023年10月,由于司美格鲁肽的效果达到预先设定提前终止试验的疗效标准,诺和诺德基于独立数据监查委员会(DMC)的建议提前终止FLOW试验。
这次公布的试验结果显示,与安慰剂相比,接受1.0 mg司美格鲁肽治疗的患者的肾脏疾病进展以及心血管和肾脏死亡风险显著降低了24%,达成试验主要终点。分析显示,复合主要终点的CKD和心血管部分均对风险降低有所贡献。此外,在验证性次要终点方面,1.0 mg司美格鲁肽相对于安慰剂的优效性亦得到证实。
安全性方面,1.0 mg司美格鲁肽显示具有良好的安全性与耐受性,与之前的试验结果一致。
司美格鲁肽是一种GLP-1受体激动剂,它能够刺激胰岛素的生成,并抑制胰高血糖素分泌,降低食欲和食物摄入量。司美格鲁肽最初作为2型糖尿病的治疗药物获批上市(商品名:Ozempic),鉴于其在减重方面的显著效果,2021年6月FDA批准其用于治疗普通肥胖患者(商品名:Wegovy),它是自2014年以来美国FDA批准的首款用于控制普通肥胖症或超重的新药。该药物并在同年晚些时候再获欧盟批准治疗肥胖适应症。
参考阅读:潜在5款重磅下一代GLP-1疗法
除了延缓肾损伤,近期所公布的临床试验结果也显示司美格鲁肽具有心血管保护的潜在益处。去年8月,司美格鲁肽达成SELECT临床3期试验的主要终点,每周一次皮下注射2.4 mg司美格鲁肽可使超重或肥胖成人发生重大不良心血管事件的风险降低20%(患者无糖尿病史)。在同月公布的STEP HFpEF临床3期试验结果也显示,每周一次2.4 mg司美格鲁肽可使患有射血分数保留型心力衰竭(HFpEF)肥胖成人患者的心力衰竭相关症状与身体限制大幅减少、改善运动功能,并导致更大幅度的体重下降。
近年来诺和诺德积极地探索司美格鲁肽在不同剂量、不同用药方式、不同领域应用的潜力。例如,CagriSema为司美格鲁肽与长效胰淀素类似物cagrilintide的固定剂量组合。去年8月公布的2期临床试验结果显示,CagriSema与司美格鲁肽或cagrilintide单药治疗相比,在体重超重的2型糖尿病患者中,导致糖化血红蛋白水平(HbA1c)和体重更大幅度的下降。经过32周的治疗后,CagriSema、司美格鲁肽与cagrilintide组病患的HbA1c分别下降2.18、1.79与0.93个百分点。此外,CagriSema、司美格鲁肽与cagrilintide组病患的体重分别下降了15.6%、5.1%与8.1%。目前CagriSema治疗超重或肥胖患者的3期临床试验已于2022年展开,预计在2025年获得结果。而CagriSema用于治疗2型糖尿病、心血管疾病患者的3期试验,也分别在去年启动。这款疗法被行业媒体Evaluate Pharma评为2024年潜在重磅的10项研发管线之一。
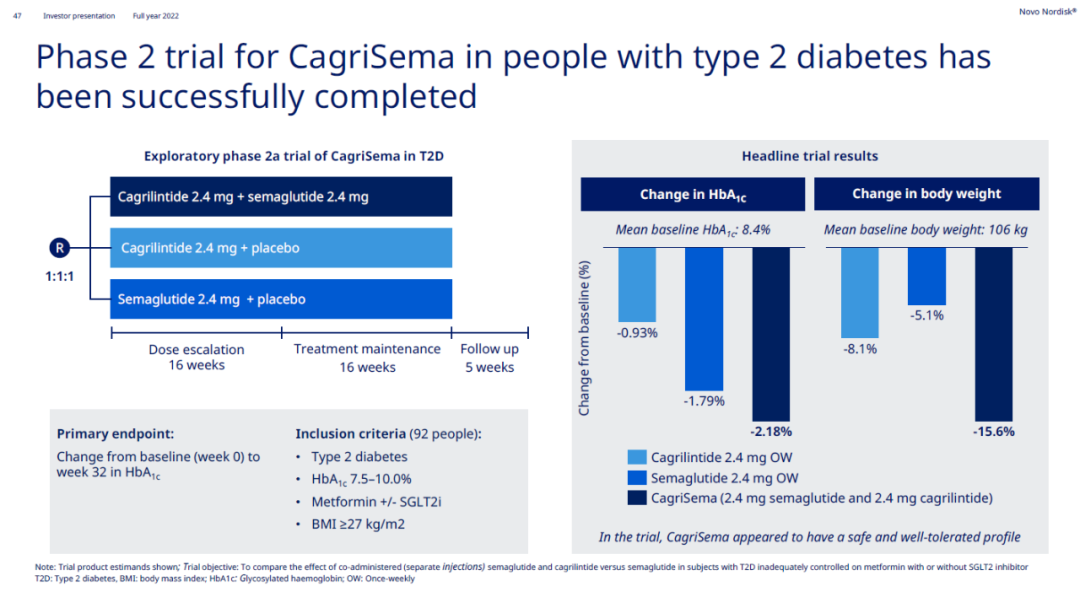
▲CagriSema在2期临床试验中的疗效结果(图片来源:诺和诺德官网)
此外,目前有两项随机3期试验EVOKE与EVOKE Plus的病患招募正在进行中,旨在检视口服司美格鲁肽用于治疗早期阿尔茨海默病患者的疗效与安全性,每项试验预计招募1840位患者,试验结果预计在2025年时会公布。而在一项包含320名非酒精性脂肪性肝炎(NASH)患者的2期临床试验中,司美格鲁肽可剂量依赖性改善患者NASH症状的消除。在治疗72周后,与安慰剂相比,显著改善NASH症状清除的同时,未导致肝纤维化的恶化。相关3期试验ESSENCE也已经启动,预计招募1200位患者,试验预计于2029年完成。

▲司美格鲁肽治疗NASH患者的2期临床结果(图片来源:诺和诺德官网)
原文链接:https://www.novonordisk.com/news-and-media/news-and-ir-materials/news-details.html?id=167028

 新浪医药
新浪医药
 2018.07.12
2018.07.12
 34380
34380

 医药地理
医药地理
 2018.10.22
2018.10.22
 18834
18834

 医谷
医谷
 2019.03.18
2019.03.18
 18794
18794