 会员动态
会员动态
 先声药业
先声药业
 2024.03.12
2024.03.12
 705
705
2024年3月10日,先声药业集团旗下抗肿瘤创新药公司先声再明宣布,其自主研发的人源化GPRC5D-BCMA-CD3三特异性抗体SIM0500的新药临床试验申请(IND)获美国食品药品管理局(FDA)批准,拟用于复发或难治性多发性骨髓瘤患者。
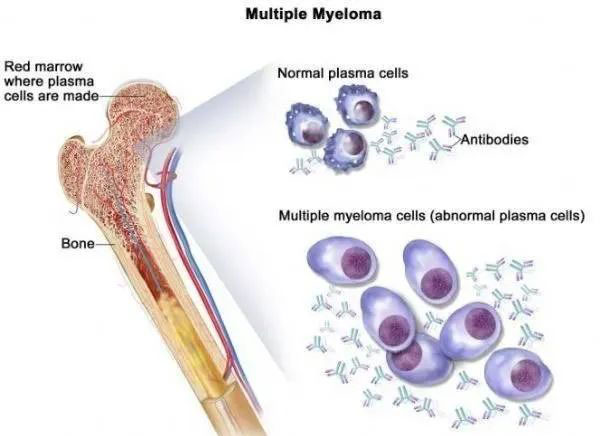
多发性骨髓瘤(multiple myeloma,MM)是血液系统第二大恶性肿瘤,主要特征是浆细胞 (即骨髓瘤细胞) 的恶性克隆并浸润骨骼及软组织,产生异常免疫球蛋白 (M蛋白) 及其多肽链。临床主要表现为骨骼疼痛,病理性骨折,肾功能损害,贫血和高钙血症。目前有多种不同作用机制药物获批并广泛用于临床,包括烷化剂、类固醇、蛋白酶体抑制剂、免疫调节药物、组蛋白去乙酰化酶抑制剂、单克隆抗体和选择性核输出抑制剂等的联合治疗,也可与高剂量化疗和自体干细胞移植联合使用。尽管MM的预后随着新疗法获批,获得了很大的改善,但该疾病目前仍然无法治愈,患者仍需更有效、可负担的治疗选择。

SIM0500是一种人源化GPRC5D-BCMA-CD3三特异性抗体,通过先声再明自有的T细胞衔接器多特异性抗体技术平台开发。该分子以低亲和力高靶向激活的CD3抗体,与抗肿瘤相关抗体组合,形成特异性靶向肿瘤的T细胞激活药物,具有多个抗体效应的协同作用。在临床前研究中,SIM0500显示出肿瘤杀伤效果显著,耐受性好,起效剂量低,停药后肿瘤不复发等多重优势,有望克服现有治疗手段所导致的耐药,具有成为多发性骨髓瘤治疗同类最佳候选药物的潜质。
SIM0500在中美两国同步开发,中国IND申请已于2024年1月2日获得中国国家药品监督管理局受理。
先声再明是先声药业集团旗下专注于抗肿瘤创新药研发、生产和商业化的生物医药公司,2023年起独立运营,致力于以突破性治疗手段, 解决中国乃至全球肿瘤领域巨大的未满足临床需求。再明着力打造高价值创新研发管线,已上市产品组合包含科赛拉®、恩维达®、恩度®三款全球创新药,正创造业绩快速增长曲线。再明与全球合作伙伴的协同创新,为临床提供更有效的治疗手段,让更多肿瘤患者再现生机与光明。媒体联络:pr@zaiming.com
先声药业(2096.HK)是一家创新与研发驱动的制药公司,建设有“神经与肿瘤药物研发全国重点实验室”。本公司重点聚焦肿瘤、神经系统、自身免疫及抗感染领域,同时积极前瞻性布局未来有重大临床需求的疾病领域,致力于让患者早日用上更有效药物。本公司以自主研发及协同创新双轮驱动,与多家创新企业、科研院校建立战略合作伙伴关系。

 豪森药业
豪森药业
 2019.05.08
2019.05.08
 27631
27631

 蒲公英
蒲公英
 2018.07.10
2018.07.10
 15508
15508

 生物制药小编
生物制药小编
 2018.06.27
2018.06.27
 14961
14961