 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley
 2024.03.29
2024.03.29
 388
388
2024年3月28日,和铂医药(股票代码:02142.HK)发布2023年财报,显示首次实现正面盈利,截至2023年12月31日止全年总盈利2276万美元。中国biotech的优等生,又交出了一份亮眼的答卷。过去两年,中国biotech面临着前所未有的挑战,行业整体低迷。和铂医药在如此严峻的形势下依然实现盈利,与其前瞻性战略布局息息相关。本文将揭秘和铂医药“和铂医疗”+“诺纳生物”的双支柱战略布局。支柱一:和铂医疗高速推进差异化管线
在自身免疫性疾病和肿瘤免疫治疗领域,和铂医疗超10条差异化管线正在高速推进,取得积极进展。

和铂医药管线(源于和铂医药官网)
1.聚焦自身免疫性疾病,巴托利单抗(HBM9161)潜力无限
IgG相关自身免疫性疾病是由致病性IgG引起的一大类疾病,可累及全身多器官,引起相应器官功能障碍,严重威胁人类健康。新生儿Fc受体(FcRn)是一种细胞受体,在防止IgG抗体降解方面发挥着关键作用,是治疗IgG相关疾病的重要药物靶点。
巴托利单抗是一种新型全人源抗FcRn单克隆抗体,可阻断FcRn-IgG相互结合,加速体内致病性IgG的清除。在治疗全身型重症肌无力的III期临床试验中,巴托利单抗取得了积极的研究结果,两轮治疗周期中,治疗组患者重症肌无力日常生活量表(MG-ADL)评分均有明显改善,且在第二个治疗周期中观察到巴托利单抗治疗产生持续改善效果。

2.差异化靶点组合,布局肿瘤免疫治疗
2.1 普鲁苏拜单抗(HBM4003)
下一代全人源抗CTLA-4抗体普鲁苏拜单抗(HBM4003),显示出增强的抗体依赖的细胞毒性作用(ADCC),对肿瘤微环境中高表达CTLA-4的Treg细胞具有极高的特异性[2]。相较传统的抗CTLA-4抗体,普鲁苏拜单抗有望突破现有的安全性瓶颈,成为肿瘤免疫治疗领域的核心产品。目前普鲁苏拜单抗已经快速推进至II期临床研究,治疗黑色素瘤、神经内分泌肿瘤、肝细胞癌等晚期肿瘤。已公布的Ib期临床数据显示出良好的耐受性和积极的有效性,具有治疗黑色素瘤同类最优潜力。

2.2 HBM1020
作为B7家族成员,B7H7/HHLA2在多种难治肿瘤中表达,且与PD-L1表达不重叠,可能在肿瘤细胞逃避免疫监视中发挥更重要的作用。
和铂医药全球首创靶向B7H7/HHLA2的全人源单克隆抗体HBM1020,因其创新的生物学机制,有望为难以从PD-(L)1抑制剂中获益的患者(尤其是PD-L1阴性/难治性患者)提供一种全新的抗肿瘤治疗方法。2023年6月,其I期临床试验在美国完成首例患者给药。
2.3 HBM1007
HBM1007出自Harbour Mice® 双重链双轻链(H2L2)转基因小鼠平台,其作用靶点CD73是一种在基质细胞及肿瘤表达的胞外酶,可将胞外腺苷单磷酸(AMP)转化为腺苷。
通过识别CD73的独特表位,HBM1007具备双重作用机制:一方面,可阻断细胞膜及可溶性CD73的酶活性,且不受AMP浓度的影响,从而在肿瘤微环境(TME)中具有持续活性;另一方面,HBM1007可减少CD73在细胞膜表面的表达,从而显著降低CD73酶依赖及非酶依赖的功能活性。目前,HBM1007获得美国FDA的新药研究申请许可(IND),将在美国启动相关临床试验。
3.靶向TSLP,HBM9378有望造福数亿哮喘患者
根据我国的流行病学调查,14岁以上人群医生诊断的哮喘患病率为1.24%,其中重度哮喘患者约占成人哮喘患者的5%-10%,全球疾病负担研究[Global Burden of Disease(GBD)Study]调查结果显示,全球哮喘患者达3.58亿[3]。
目前推荐的重度哮喘的治疗方案包括中高剂量ICS(吸入糖皮质激素)- LABA(长效β2受体激动剂),生物制剂及口服激素,许多重度哮喘患者的病情仍未得到控制。
HBM9378/SKB378是和铂医药与科伦博泰合作研发的全人源单克隆抗体,由和铂医药H2L2平台产生。HBM9378可靶向胸腺基质淋巴细胞生成素(TSLP),通过阻断该因子和受体的相互作用来抑制TSLP介导的信号通路,治疗过敏性气道炎症导致的哮喘。传统抗IgE抗体、抗IL-5(R)抗体以及抗IL-4R抗体多靶向某一群致病性免疫细胞,单独使用可能无法有效控制重度哮喘,而抗TSLP抗体具有同时抑制多个致病性免疫细胞的能力(如下图所示),在重度哮喘治疗方面具有潜在优势。
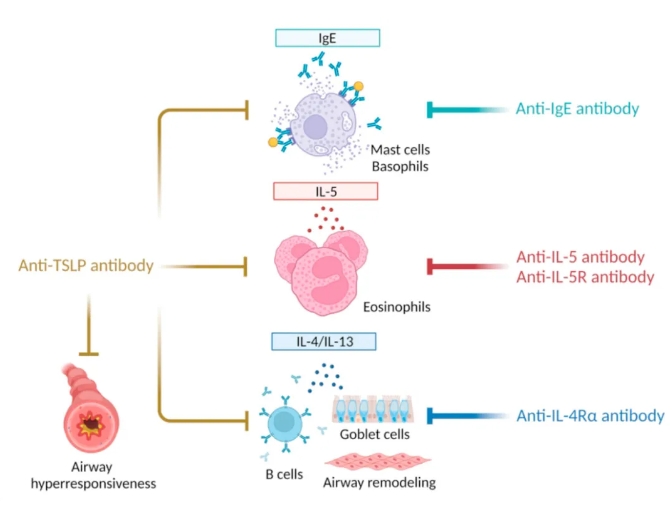
TSLP抗体与其他哮喘抗体药物作用机制差异[4]
4.多元化合作,加速创新型疗法的研发进程
HBM7008 是全球临床阶段唯一一款靶向B7H4x4-1BB的双特异性抗体,由和铂医药创新的免疫细胞衔接器HBICE®平台开发,由于其高度依赖以肿瘤相关抗原(TAA)为介导,因此不仅在T细胞共刺激和抑制肿瘤生长中表现出较高的效力,而且有望避免在其他产品中观察到的4-1BB肝毒性风险,具有更好的安全性。其对肿瘤的独特特异性和免疫调节活性,使其成为PD-L1阴性或PD-1/PD-L1耐药患者的一种很有前途的治疗方法。
2023年2月14日,和铂医药宣布与Cullinan Oncology, Inc.(纳斯达克:CGEM)签订授权及合作协议,授予Cullinan Oncology在美国(包括哥伦比亚特区和波多黎各)开发及商业化HBM7008(Cullinan Oncology产品代号为CLN-418)的独家许可权。根据协议,和铂医药将获得2500万美元预付款和最高达6亿美元里程碑付款,以及最高近20%销售额百分比的分级特许使用权费。此外,和铂医药与其他合作伙伴共同推进5项临床试验获批,包括HBM7022/AZD5863(合作方:阿斯利康);HBM1029, HBM7015, HBM7020(合作方:华兰基因);NK-010(合作方:恩凯赛药)。
支柱二:诺纳生物赋能全球生物药创新
2022年11月,和铂医药成立全资子公司诺纳生物(Nona Biosciences),致力于前沿技术创新,并为合作伙伴提供涵盖靶点验证和新一代生物大分子药物从发现至临床前研发等 Idea to IND(I to ITM)完整服务。
目前,诺纳生物已建立四大技术平台,覆盖蛋白质工程、细胞治疗、抗体偶联技术和药物递送,未来可向各创新技术平台扩展。
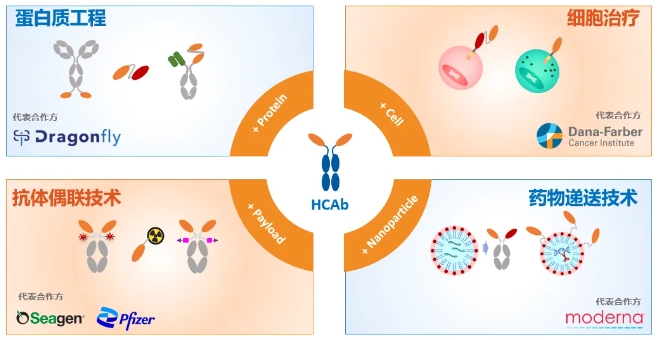
2023年12月15日,诺纳生物宣布,与辉瑞就靶向人间皮素(MSLN)抗体偶联药物(ADC)HBM9033的全球临床开发和商业化签订独家授权协议。
根据协议,诺纳生物将获得5300 万美元预付款和近期付款,及最高达 10.5 亿美元的里程碑付款,此外,诺纳生物还有资格从净销售额中获得从高个位数到高十位数不等的分级特许权使用费。
MSLN是一种在多种实体瘤中上调的TAA。HBM9033中的全人源单克隆抗体(mAb)来自于Harbour Mice®平台,具有良好的特性,与游离型MSLN(sMSLN)的结合减少,同时保持与膜结合型MSLN的强结合和内化。独特的抗体设计确保了HBM9033在各种不同MSLN表达水平的临床前肿瘤模型中具有优越的疗效和安全性,HBM9033有潜力成为全球同类最佳的治疗选择。
而在HBM9033之外,诺纳生物还与Dragonfly Therapeutics签订合作协议,利用公司专有的HCAb转基因小鼠平台生成全人源重链抗体,用以开发双特异性抗体及多特异性抗体疗法。
此前,诺纳医药已与莫德纳(Moderna)签订授权合作协议,预付款600万美元,里程碑付款最高5亿美元。莫德纳将获得一组由HCAb平台开发的针对多个靶点序列的独家可再授权许可,用于基因疗法的研发。
诺纳生物利用已验证的行业领先技术平台,迅速获得辉瑞等数十家药企青睐,达成多项里程碑式合作。同时,根据行业发展需要,诺纳生物持续进行技术创新,拓展至蛋白质降解、人工智能等新兴领域,开发下一代HBICE®平台,巩固在双特异性抗体研发领域的领先地位,利用mRNA技术与HBICE®平台相结合开发新一代肿瘤免疫疗法,在细胞治疗领域,Harbour Mice®平台还在持续赋能丹娜-法伯研究所等机构进行新型CAR-T药物开发。
三、双支柱驱动,未来可期
技术快速迭代创新是Biotech的灵魂;产品管线高速推进,成功商业化,是Biotech的生命线。自成立之初,和铂医药就投身于源头创新,对技术平台进行前瞻布局,并逐渐建立了和铂医疗和诺纳生物双核心支柱的业务模式,不断拓宽底层技术平台能力,开发“first-in-class”、“best-in-class”的产品管线,在全球范围内引领新一代生物治疗创新。
创新的研发和合作模式已初见成效。2023年,和铂医药首次实现正面盈利。未来,依托强健的持续迭代创新能力,和铂医药将不断穿越周期,稳健增长,实现“和创新药,铂铸健康” 的使命。
参考资料:
[1] 重症肌无力的诊断与治疗. 李柱一. 常婷. 中华神经科杂志, 2022,55 (3) : 238-247. DOI: 10.3760/cma.j.cn113694-20211225-00928.
[2]Brianna M Lax., et al., Both intratumoral regulatory T cell depletion and CTLA-4 antagonism are required for maximum efficacy of anti-CTLA-4 antibodies. PNAS. 2023 Aug;120(31)
[3]中华医学会呼吸病学分会哮喘学组,支气管哮喘防治指南(2020年版),中华结核和呼吸杂志, 2020,43(12) : 1023-1048. DOI: 10.3760/cma.j.cn112147-20200618-00721
[4] M.Kurihara et al. Current summary of clinical studies on anti-TSLP antibody,Tezepelumab, in asthma, Allergology International 72 (2023) 24e30

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49722
49722

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34736
34736


 2014.03.11
2014.03.11
 31135
31135