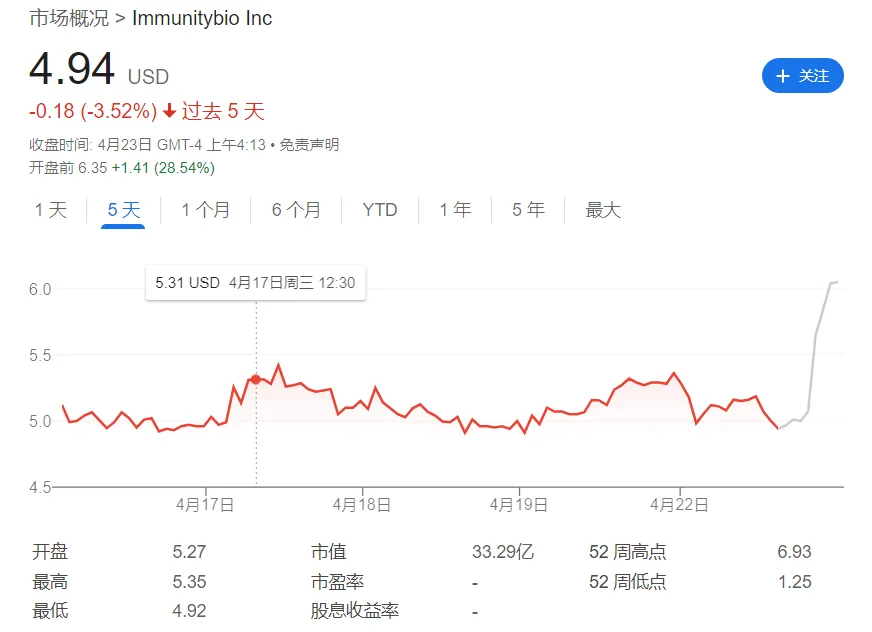
 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley
 2024.04.25
2024.04.25
 112
112
2024年4月22日,ImmunityBio的IL-15超级激动剂N-803获得FDA批准上市,与卡介苗(BCG)联用于对卡介苗无反应的高危非肌肉浸润型的膀胱癌(CIS、乳头状病灶)患者治疗,商品名为Anktiva。
N-803的获批是24年来首个针对该类患者的新疗法,大幅降低了膀胱切除率。受此影响,ImmunityBio股价盘后上涨了20%。
因CMC缺陷被延迟
N-803是一种IL-15超级激动剂,由IL-15突变体(IL-15 N72D)、IL-15受体α链和Fc受体构成。一方面,ImmunityBio引入Fc片段来延长其半衰期,另一方面,对IL-15 N72D位点突变来增强其生物活性。与单独使用IL-15相比,N-803更稳定,在体内的存活时间更长,能更好地刺激免疫系统更长时间。
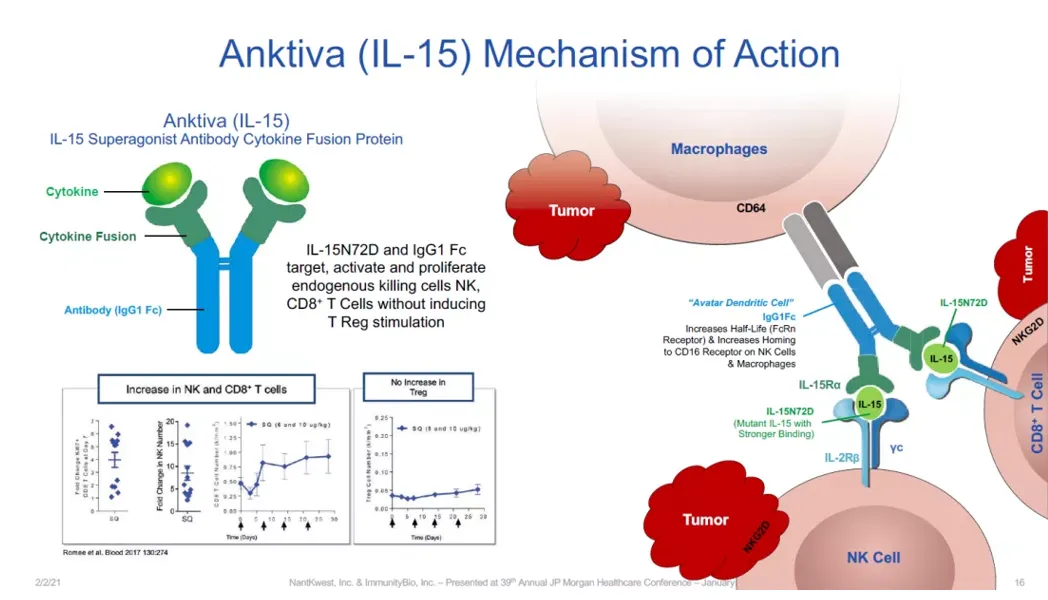
N-803的成功对于这个适应症人群是非常大的一个突破,有高达40%的NMIBC)患者对BCG无反应。N-803对这类人群的疗效十分突出。
基于171受试者的Ⅰ/Ⅱ期及一项84名受试者入组的关键临床研究QUILT3032数据,N-803于2022年5月首次向FDA提交BLA,在该项临床中,与FDA批准的与现有疗法相比,71%先前BCG治疗失败的患者对N-803+BCG的响应及中位持续时间超过50%。
但在2023年5月,因第三方合同制造商存在缺陷,FDA拒绝了其上市申请。在CRL中,FDA提供了解决CMC问题的建议,并要求提交“反应持续时间以及安全性数据。不过没有要求进行新的临床前或临床III期安全性或有效性研究。
这个挫折正值公司处于艰难时刻,2023年Q1季度,公司净亏损1.17亿美元,账上现金余额9126万美元。受此影响,ImmunityBio股价也大跌了55%。
CMC问题虽并非致命,问题得到解决后依然能够取得批准,但是延迟了上市进程同样会给制药商造成可见与无形的损失。
被拒后,ImmunityBio更新了QUILT 3.032响应持续时间数据并在再次提交了上市申请,2023年10月,再提交的上市申请获得了FDA受理,PDUFA日期设定为 2024年4月23日。
在更新数据中,此前对N-803有响应患者的缓解持续时间延长,CR维持时间≥24个月的概率为60%,≥24个月时无膀胱切除率超过90%。
N-803不错的疗效也让公司得到了一笔至关重要的资金注入。2024年1月,Oberland Capital与ImmunityBio与签署了一项高达3.2亿美元合作协议,以加速N-803的商业化以及临床试验开发。该笔协议包括2.1亿美元的即时投资,以及N-803获得FDA批准后的1亿美元额外资金。
ImmunityBio还开发了N-803的非小细胞肺癌适应症,目前处于Ⅱ期临床阶段。N-803与PD-1单抗联用的ORR为38%(15个 PD-L1高表达的患者中),mOS 17个月。
IL-15的过往
IL-15于1994年被发现。2008年一篇发表NCI上的“Twelve immunotherapy drugs that could cure cancers"一文中将IL-15视为潜在肿瘤免疫治疗手段之一。
IL-15是一种多效能性细胞因子,在NK、T和B细胞的发育、存活和活化中起着核心作用。IL-15不仅能够增加NK细胞和T细胞数量,而且可以激活NK细胞和细胞毒性CD8+T细胞,从而起到杀伤肿瘤和其他病原体的作用。在肿瘤局部,IL-15具有对淋巴细胞增殖的作用,对目前常用免疫抑制剂如抗PD-1抗体无反应的“冷肿瘤”变成有反应的“热肿瘤”的潜力。
在IL-15的开发上,曾有不少熟悉企业,如恒瑞生物、博际生物、Bioniz Therapeutics等等。但是除了ImmunityBio之外,几乎都没有取得什么进展。恒瑞的SHR-150已经多年没有音讯,博际生物已经破产清算。
总结
天然的IL-15存在半衰期短以及单体生物活性较低,开发起来困难重重,临床进度缓慢。去年10月,SOTIO的IL-15超级激动剂Nanrilkefusp alfa因疗效不足停止开发。如今N-803能够取得疗效突破且获得监管批准,意味着,细胞因子在肿瘤治疗中的重要辅助作用和临床价值重大。
参考出处:
https://firstwordpharma.com/story/5738548
IL-15的抄底人
IL-15超激动剂的死与活

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49761
49761

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34762
34762


 2014.03.11
2014.03.11
 31148
31148