 产业资讯
产业资讯
 医麦客
医麦客
 2024.04.26
2024.04.26
 132
132
业内通常将一款年销售额超过10亿美元的药物称为“重磅炸弹”药物(Blockbuster Drugs),即俗称“十亿美元分子”,这类产品通常具有疗效佳、科技创新强、市场培育好等特点。近年来,生物医药领域发生了巨大的变革,临床需求的剧烈释放给创新药带来了冲击重磅炸弹药物的机遇。
2023年,百济神州泽布替尼全球销售额突破十亿美元大关,成为国内首个“十亿美元分子”。而随着二线顺利获批,传奇生物首款BCMA CAR-T细胞治疗产品CARVYKTI®便是2024年有望冲线“十亿美元分子”的候选药物中最为亮眼的一个。
今年4月,美国食品药品监督管理局(FDA)和欧盟委员会(EC)先后批准CARVYKTI®用于复发或难治性多发性骨髓瘤(RRMM)患者的二线治疗,这是全球首款且唯一获批RRMM二线治疗的BCMA靶向疗法,包括CAR-T疗法、双特异性抗体和抗体药物偶联物(ADC)。
以临床数据为基石,
二线获批实至名归
从“ORR 100%”的惊艳亮相开始,临床数据一直都是传奇生物的 “底气”。当地时间2024年4月22日,传奇生物CARVYKTI®(西达基奥仑赛,cilta-cel)继4月初在美国获批二线后又迎来了欧盟委员会的批准,用于治疗复发和难治性多发性骨髓瘤成人患者,这些患者既往至少接受过一线治疗,在最后一次治疗出现疾病进展并且对来那度胺耐药。这意味着, BCMA CAR-T疗法正式迈入血液肿瘤前线用药,多发性骨髓瘤的治疗格局有望迎来里程碑式改变。
不久前,基于首个国际随机、开放标签的3期研究CARTITUDE-4的结果,美国FDA肿瘤药物咨询委员会(ODAC)以11:0全票认为CARVYKTI®用于二线适应症的风险-效益评估结果良好。在中位随访16个月时,与标准治疗方案(SOC)相比,CARVYKTI®降低了既往接受过1-3线治疗且来那度胺耐药的多发性骨髓瘤成人患者74%的疾病进展或死亡风险(风险比为0.26)。CARVYKTI®组mPFS显著改善(NR vs 11.8个月,HR=0.41),研究达到主要终点;关键次要终点ORR同样显示获益(85% vs 68%),两组中位OS分别为未达到和26.7个月。总体来说,CARVYKTI®在既往1-3线治疗且来那度胺难治的RRMM患者中具有显著的PFS和ORR获益。
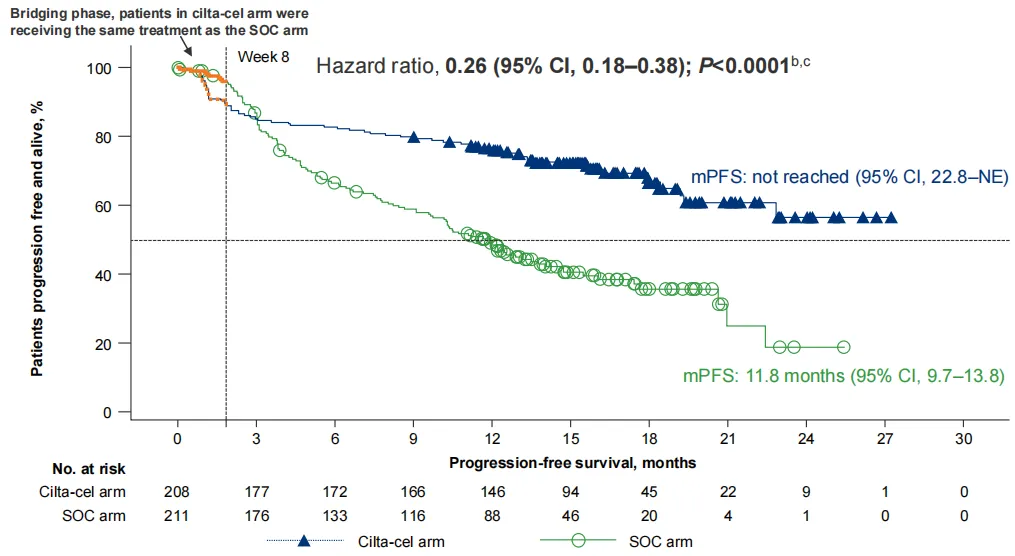
▲ Cilta-cel组和SOC组患者的中位无进展生存期和存活率数据(图片来源:参考资料[3])
安全性方面,3级CRS发生率仅为1%,且所有患者CRS和ICANS均已缓解。与会专家表示,不认为前期风险应该归因于治疗本身,而且长期PFS令人信服。传奇2023全年财报中披露,CARVYKTI®已在全球80多家授权治疗中心治疗了超2500例患者,这些患者的积极疗效及显著获益验证了产品的有效性,也为其安全性提供了实证支持。在CAR-T产品被要求新增黑框警告下,本次提线申请赢得ODAC一致通过的积极意见足以令临床及产业界备受鼓舞。
更为重要的是,CARVYKTI®成功获批二线治疗,有望打开企业与患者双赢的新局面。对企业来说,提线治疗能覆盖更多患者,从四线后到二线起,患者覆盖比例从15%增至95%,预计患者基数将扩大6倍,给CARVYKTI®销售额的增长留下了巨大的想象空间。从患者获益角度,前线治疗的患者往往表现出较低的耐药度,同时拥有更好的免疫细胞活性,这将有助于提高患者治疗的成功率及最终的受益程度,客观上降低了治疗风险。
从CARVYKTI®临床研究布局来看,传奇生物的“野心”也不仅满足于二线获批。正在进行的CARTTITUDE-5是全球首个一线治疗的关键头对头3期临床试验;CARTTITUDE-6更是直接对照骨髓移植,在前线治疗方面全面布局。目前,投资界与医药界均在密切关注CARTITUDE-5的进展情况,若后续数据结果表现积极,有望成为一线MM适应症的标准疗法,CARVYKTI®的市场应用空间将更加广阔。
除了数据的硬核支持,改善患者体验的软实力同样是本次获批的一大亮点。在ODAC评审会议中,患者代表分享到:接受CARVYKTI®治疗时,患者在医疗机构或指定诊疗中心接受一次输注即可,无需长期住院治疗,极大地提高了患者生活质量,这一便捷地给药方式,推动了患者在细胞疗法决策上的积极选择。此前,CAR-T细胞疗法被纳入美国NCCN指南,这既是对细胞疗法临床研究和应用的权威认可,也为临床医生提供了有力的指导,帮助他们为患者提供更优的个体化治疗。在兼具安全性、有效性和给药便捷的综合优势下,CARVYKTI®的产品在多发性骨髓瘤治疗市场中极具竞争力。
以全球商业化为风帆,
“十亿美元分子”春山在望
2023年,CARVYKTI®全年销售额达5亿美元,有赖于合作伙伴强生具备全球性的商业化能力,以及CARVYKTI®展现出的同类最优(BIC)药物的潜力。近日,强生公布了2024年一季度业绩,其中CARVYKTI®实现销售额1.57亿美元,较去年同期大增118%。
作为全球第二款上市的BCMA靶点CAR-T产品,CARVYKTI®尽管不具备先发优势,然而,凭借其高达97%的总缓解率的疗效优势,CARVYKTI®自2022年获批后至今便达到7.91亿美元的全球销售。对于CAR-T疗法而言,向前线治疗拓展是实现营收增长的重要途径。基于全球首个且唯一获批二线适应症的市场优势,强生预测今年CARVYKTI®的销售额将突破10亿美元,下一个“十亿美元分子”指日可待。
众所周知,想要打造“重磅炸弹”药物,不仅要看企业的研发设计和以临床数据为基础的产品竞争力,还需考验企业全球商业化布局的能力。从这个角度来看,传奇生物算是个不偏科的“优等生”。
据报道,传奇自成立之初就确立了In China, For Global的理念。2017 ASCO年会上,“100%总缓解率”让传奇生物一炮而红,随后迅速与跨国药企强生达成战略合作,成为业内津津乐道的“license out”合作经典案例。面对生物医药行业的“双十定律”,传奇生物深谙用资本赋能技术创新之道,积极引进海内外风投,成立海外团队,并根据市场情况选择在2020年美股上市,成为“中国CAR-T海外上市第一股”。
传奇生物CEO黄颖博士曾公开表示:从首付款的资金支持,到全球临床试验设计与执行能力不断提升,授权出海大大地加速了产品的临床开发和商业化发展进程。2018年上半年,传奇生物接连拿下了中美两地的临床批件,仅4年就获得批准上市,在新药研发到上市的速度上刷新了行业纪录。凭借着CARVYKTI®积极的商业化和优异的临床表现,传奇生物最高市值冲击137.08亿美元,一跃成为当时全球市值最高的细胞治疗公司。

▲ 释放CARVYKTI®的力量(图片来源:参考资料[3])
凭借着同类最优(BIC)的产品优势及全球化的商业布局,配合强生雄厚的全球资源,产品有望持续放量,实现业绩的强劲增长。据公开媒体报道,CARVYKTI®已在美国、欧洲、日本等40个国家和地区获批上市,全球累计逾2700名患者接受了治疗。目前,CARVYKTI®在中国的新药上市申请(NDA)已处于优先审评队列,相信不日便将迎来审批,惠及中国患者。
为满足日益增长的市场需求,传奇生物和强生公司在产能方面也在不断扩大投资,加速推进全球生产建设。今年4月,传奇生物扩大了与诺华在临床和商业化供应的合同生产服务内容,进一步优化了CARVYKTI®全球产能供应布局。传奇生物曾在电话会中提及,公司正在进行10亿美元的资本开支计划,在2025年底有望达到10000份剂量的生产水平。强生公司供应链副总裁Kimberly Lounds Foster表示,计划在美国和瑞士将其慢病毒产量从20升扩大到50升,进一步增加慢病毒产能,持续加强全球供应链布局,以满足不断增长的患者需求。
以政策引领为东风,
助力创新药高质量发展
生物医药产业是创新驱动的产业,是实施创新驱动发展战略的主战场,也是当前国内外产业布局的重点。2023年中国医药科技论坛上,全国政协经济委员会副主任、中国国际经济交流中心理事长毕井泉认为,“需从六个方面同向发力,在研发、转化、准入、生产、使用、支付各环节对生物医药创新给予全链条的支持,努力营造一个鼓励生物医药创新的制度环境,推动产业高质量发展”。他认为,近些年来,我国生物医药产业开始走上高质量发展的道路,但仍处于“爬坡过坎”阶段,面临诸多待解难题。此外,在生物医药领域还存在预期减弱、资本市场低迷、企业融资困难、源头创新能力薄弱等方面的挑战。
今年3月,一份由国家发展改革委联合国家卫生健康委牵头制定的《关于全链条支持创新药发展实施方案》的“征求意见稿”如“重磅炸弹”一般席卷了中国医药圈,其核心要点在于通过政策引导和支持,全面促进创新药的研发、审批、上市、使用、支付等关键环节,重点支持新靶点、新机制、新结构、新技术且有自主知识产权的药物,对于创新药企来说,这则消息无疑是一针“强心剂”,极大提振了中国创新药发展的信心。
通过政策、资本、企业和人才的近十年的共同发力,中国医药创新实力快速提升有目共睹。一批优秀的创新企业步入成长期,一批具有全球竞争力的公司开始显现。而正是源头创新能力、差异化的管线布局、与国际监管标准接轨、广泛吸引全球融资、与跨国大药企达成合作等前瞻性布局,传奇生物给中国创新药又快又好的高质量发展目标提供了一个可参考的样本。
从2018年拿到中国首个细胞治疗临床批件到顺利获得美、欧、日批准上市,传奇用了不到6年时间;从向美国FDA、欧盟委员会提交扩大适应症申请到正式批准,不到一年。这样的“传奇速度”为国内生物创新药领域传递了积极信号:中国原创的BCMA靶向CAR-T细胞治疗产品,顺利通过了全球最严级别监管审批,为中国生物医药产业差异化、多元化创新发展树立了标杆典范,对医药行业从早期临床到商业化的价值链重塑将提供有益启发。
如果“征集意见稿”全面落定,在促进中国创新药高质量发展过程中给以全链条支持,构建起一个良性产业生态环境,那么,一个前所未有的创新药新时代即将到来。我们相信,未来将有更多具有自主知识产权和显著临床疗效的中国创新药将走向世界,惠及全球患者。
参考资料:
1.Legend Biotech’s CARVYKTI® (ciltacabtagene autoleucel) Becomes the First and Only BCMA-Targeted CAR-T Cell Therapy Approved by the FDA for Second-Line Treatment of Multiple Myeloma. Retrieved April 6, 2024 from https://www.businesswire.com/news/home/20240405663733/en
2.https://www.investor.jnj.com/news/news-details/2024/CARVYKTI-ciltacabtagene-autoleucel-cilta-cel-is-the-first-BCMA-targeted-treatment-approved-by-the-European-Commission-for-patients-with-relapsed-and-refractory-multiple-myeloma-who-have-received-at-least-one-prior-line-of-therapy-2024-dp-7GFW3ET/default.aspx
3.传奇生物2024年财报

 CPhI制药在线
CPhI制药在线
 2018.07.24
2018.07.24
 49798
49798

 艾美仕
艾美仕
 2018.07.09
2018.07.09
 34788
34788


 2014.03.11
2014.03.11
 31167
31167