 会员动态
会员动态
 2017-01-17
2017-01-17
 4672
4672
来源:药明康德 2017-01-17
今天,药明康德合作伙伴和记黄埔医药宣布了多个临床试验相关的好消息。

▲和记黄埔医药的在研新药(图片来源:和记黄埔医药官网)
首先,和记黄埔医药将于2017年1月19日至21日在美国加利福尼亚州旧金山举行的美国临床肿瘤学会(ASCO)资助的2017年胃肠癌研讨会上公布正在进行的1/2期临床数据,使用在研新药fruquintinib联合紫杉醇(Taxol)二线治疗晚期胃癌患者。
Fruquintinib(HMPL-013)是血管内皮生长因子受体(VEGFR)的高效选择性口服小分子抑制剂,通过每24小时口服剂量抑制VEGFR活性,而没有已知的靶外毒性。目前正由和记黄埔医药及其礼来公司在中国共同开发。
在癌症晚期,肿瘤分泌大量血管内皮生长因子(VEGF),这是一种在肿瘤周围刺激形成过多血管系统的蛋白质配体,以便向肿瘤部位提供更多的血液流动、氧气和营养物。VEGF和VEGFR在肿瘤相关的血管生成中起关键作用。 抑制VEGF/VEGFR信号通路的代表了阻断肿瘤生长和侵入所必需的新血管发展的重要治疗策略之一。
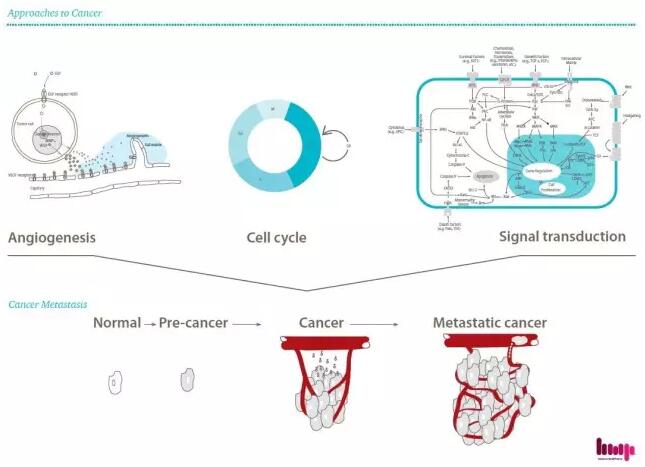
▲和记黄埔医药的研发思路(图片来源:和记黄埔医药官网)
根据Frost&Sullivan的数据,每年估计世界上大约有100万新增病人被诊断为胃癌。2015年,来自中国的患者约占全世界新诊断胃癌病例的44%。与世界其他地区相比,中国胃癌的高发病率被认为部分与食物制备习惯相关,例如使用某些防腐剂。根据中国国家中央癌症登记处的数据,2015年中国估计有68万例胃癌病例和49.8万例死亡病例。
胃癌是世界上第三大最致命的癌症。由于常常诊断为晚期,预后较差,中位OS小于12个月。虽然中国本土的靶向治疗正在开发中,但化疗仍然是胃癌患者的主要治疗方法,仅赋予中等的生存优势。因此,中国胃癌患者对新型靶向治疗选择方案具有高度医疗需求。
这项1/2期研究旨在评估fruquintinib与紫杉醇联合作为二线治疗的中国晚期胃癌患者的耐受性、药代动力学(PK)和初步疗效。该开放臂1/2期试验(NCT02415023)由剂量发现和剂量扩增阶段组成。在剂量发现阶段,结合标准80毫克/平方米的紫杉醇(每周一次)评价三个剂量水平的fruquintinib(每日一次2、3、4毫克),直到达到最大耐受剂量(MTD)或推荐的2期剂量(“RP2D”)。截至2016年9月10日,共有32名患者入组,fruquintinib的RP2D测定为每日4mg。
32名患者中的28名被评估了肿瘤反应,其中10名患者确认部分反应(客观缓解率,ORR= 35.7%),9名患者经历至少8周的疾病稳定(DCR=67.9%)。在fruquintinib的RP2D状况下,16周无进展存活(PFS)为50%,7个月的总生存(OS)为50%。
初步结论是fruquintinib和紫杉醇的联合治疗似乎在晚期胃癌的二线设置中具有肿瘤反应希望且一般良好耐受性。在随机对照试验中进一步评价fruquintinib是有必要的。
同时,今天和记黄埔医药也宣布,已经开始启动了fruquintinib和Iressa(吉非替尼)联合治疗的2期临床研究,在中国一线治疗晚期或转移性非小细胞肺癌(NSCLC)患者。
这个2期联合治疗研究是一个多中心、单臂、开放标签研究。目的是评价联合治疗在具有表皮生长因子受体EGFR激活突变的晚期或转移性非鳞状NSCLC患者的一线治疗设置中的安全性和耐受性以及初步功效。
根据Frost&Sullivan的数据,每年估计世界上大约有170万新患者被诊断患有NSCLC。肺癌是男性和女性癌症死亡的主要原因,约占所有癌症死亡数量(根据美国癌症协会)的四分之一,并且超过乳腺癌、前列腺癌和结直肠癌加起来的总和。具有EGFR活化突变的NSCLC患者,其比例在美国和欧洲的估计占10-15%,在亚洲约占30-40%,对目前可用的EGFR-TKI的治疗特别敏感。然而,肿瘤几乎总是对治疗产生抗性,导致疾病进展。抑制不同信号传导通路的组合疗法具有比单一通路抑制更有效且克服肿瘤抗性的潜力。
Iressa是由阿斯利康公司(AstraZeneca)开发的一种靶向单一疗法,用于治疗晚期或转移性EGFR激活突变阳性的NSCLC患者。 Iressa通过抑制EGFR中的酪氨酸激酶(TKI)而起作用,因此阻断涉及肿瘤生长和扩散的信号传递。Iressa已经在全球91个国家获得批准。
除了在研新药fruquintinib外,和记黄埔医药今天也开始在中国使用sulfatinib二线治疗胆管癌的2期研究。
胆管癌是由胆管上皮引起的罕见但致命的恶性肿瘤,包括肝内胆管癌和肝外胆管癌,它是世界上第二最常发生的肝癌,排在肝细胞癌之后,约占所有肝癌病例的5%。根据美国国家癌症研究所的数据,2017年美国将有大约1.8万个新增胆管癌病例。然而,在中国,发病率可能高达西方世界观察到的40倍。
吉西他滨(gemcitabine)是目前用于胆管癌患者的一线治疗方案,作为单一疗法或与顺铂组合,并且在全世界范围还没有确立针对该种致死性疾病的二线治疗手段。诊断有不可切除或转移性胆管癌患者的平均预期寿命小于12个月。因此,这些患者对新的靶向治疗选择有高度未满足的医疗需求。
Sulfatinib是一种口服的新型血管免疫激酶抑制剂,选择性靶向血管内皮生长因子受体(VEGFR),成纤维细胞生长因子受体(FGFR)和集落刺激因子-1受体(CSF-1R),它们是涉及肿瘤血管生成和免疫逃避的三种关键性的酪氨酸激酶受体。抑制VEGFR信号传导途径可以起到阻止肿瘤周围血管生长的作用,从而使肿瘤“挨饿”,缺乏迅速生长所需要的营养物和氧气。通过抗VEGFR治疗而增加的FGFR信号通路的异常活化也会促进肿瘤生长、血管生成和骨髓衍生的抑制细胞的形成,与癌症进展相关,也需要相关调控。最后,抑制CSF-1R信号通路可阻断肿瘤相关巨噬细胞的激活,涉及抑制针对肿瘤的免疫应答。
这项2期研究是一个多中心、单臂、开放标签研究,以评估sulfatinib作为单一疗法的治疗晚期或转移性胆管癌患者的的疗效和安全性,他们有过一个失败的全身治疗。主要终点是16周时的无进展存活(PFS),其次要终点包括客观反应率(ORR)、疾病控制率(DCR)、反应持续时间(PFS) 和安全性。
除了针对胆管癌的临床试验,和记黄埔医药正在中国和美国进行六项sulfatinib临床试验,包括两项在神经内分泌肿瘤患者(SANET-p和SANET-ep)中的3期临床研究和一项针对甲状腺癌患者的2期研究。
我们衷心祝福临床试验早日成功,以便造福大量癌症患者。

 会员动态
会员动态
 中国医药创新促进会
中国医药创新促进会  2025-05-26
2025-05-26
 115
115

 会员动态
会员动态
 中国医药创新促进会
中国医药创新促进会  2025-05-19
2025-05-19
 200
200
 会员动态
会员动态
 北海康成
北海康成  2025-05-17
2025-05-17
 273
273