 会员动态
会员动态
 2016-11-25
2016-11-25
 7674
7674
来源:药渡 2016-11-24
(1)信达生物制药成立于2011年8月,俞德超博士为共同创始人、董事长兼总裁。
(2)信达产业化基地目前总投资9亿元。已有2*1000L的生产线正在运营,4* 2000L的生产线正在建设中,以及4*15000L规模的生产线在规划中,各产线符合CFDA、FDA和EMA的cGMP。
(3)融资情况:
2011年10月,完成A轮融资,由美国富达(Fidelity Investment Group)主导;
2012年6月,完成B轮融资,由礼来亚洲基金(Lilly Asia Ventures)主导;
2015年1月,完成C轮融资,由君联资本(Legend Capital)、淡马锡(Temasek)主导。
目前总共获得4.9亿美元融资。
根据官方透露, 信达生物搭建了12个具有自主知识产权的单抗产品链,两个新药品种入选国家“重大新药创制”专项。
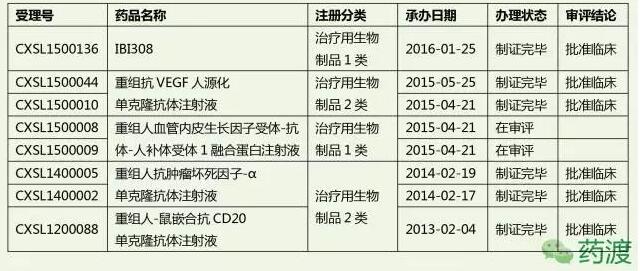
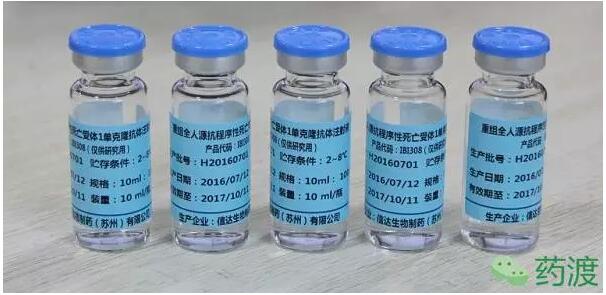
(1)IBI308:重组全人源抗程序性死亡受体(programmed death receptor 1 ,PD-1)单克隆抗体,在2016年9月获批临床。此项目为特殊审批品种,也获得国家重大专项支持。
IBI308单药或联合化疗治疗晚期恶性肿瘤受试者的I期临床研究正在招募中,目标国内入组104人。第一例受试者于2016年10月24号入组。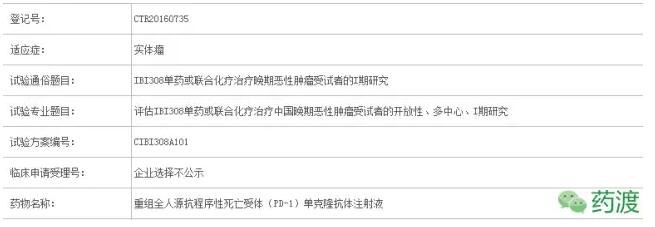
(2)IBI303:重组人抗肿瘤坏死因子-α单克隆抗体注射液,为阿达木单抗生物类似药(Adalimumab biosimilar)。
IBI303的氨基酸序列与阿达木单抗一致。在灵长目动物的头对头试验中,IBI303在PK/PD,与阿达木单抗高度相似。在小样本的临床探索试验中,IBI303在健康受试者上表现出良好的安全性。
活动性强直性脊柱炎患者中比较IBI303和原研药阿达木单抗的疗效和安全性的随机、双盲、平行对照Ⅲ期临床研究(登记号为:CTR20160628)正在招募中,目标入组:国内试验-400人。
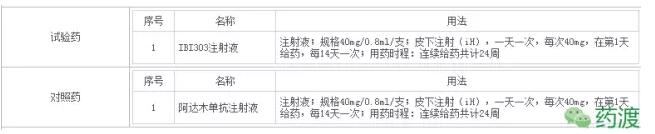
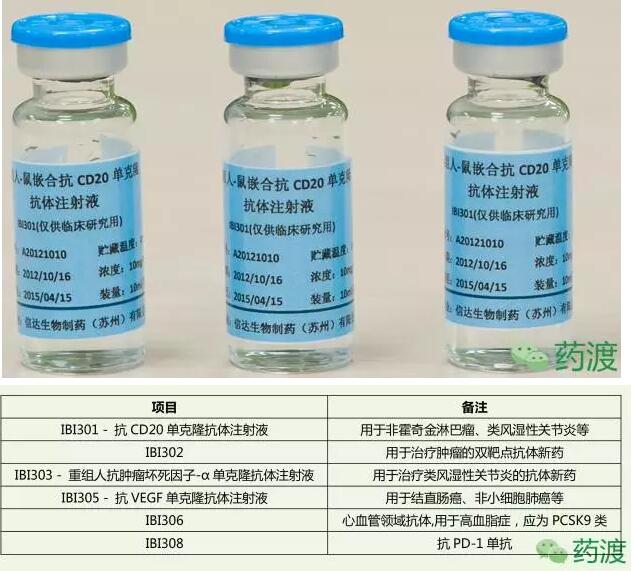
(3)IBI301:重组人-鼠嵌合抗CD20单克隆抗体注射液,为信达生物第一个获批临床的品种。为利妥昔单抗生物类似药。在2016年8月,开始了弥漫性大B细胞淋巴瘤(DLBCL)Ⅲ期临床研究。
CD20阳性B细胞淋巴瘤I期正在进行中,非霍奇金淋巴肿瘤I期已经完成。
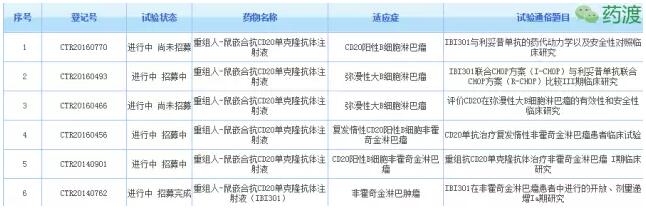
(4)IBI305:抗VEGF单克隆抗体注射液。本品为贝伐单抗生物类似药(Bevacizumab biosimilar)。
在非小细胞肺癌受试者中比较IBI305联合紫杉醇/卡铂与贝伐珠单抗联合紫杉醇/卡铂有效性和安全性的III期研究(登记号:CTR20160848)正在招募中,目标国内入组436人。PI为中山大学肿瘤防治中心张力博士。
主要终点指标为:客观缓解率(ORR),根据RECIST v1.1标准评价ORR,其定义为肿瘤体积缩小达到预先规定值并能维持最低时限要求的受试者比例。(完全缓解(CR)+部分缓解(PR))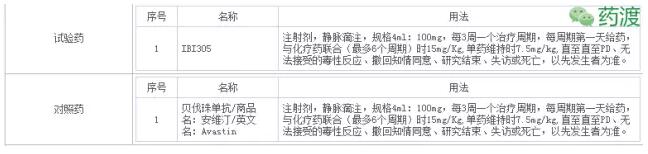
(5)查询Clinical Trials,录入的几个临床试验均是在国内展开的。不过在招募状态和CFDA临床试验登记平台有所差异。临床试验CRO为康德弘翼(WuXi CDS)。
从官网信息了解到俞德超博士暂时并未想开展海外临床试验(此前JHL已经在欧洲开展了利妥昔单抗生物类似药临床试验),这也正和公司愿景一致(开发出中国老百姓用得起的高质量生物药)。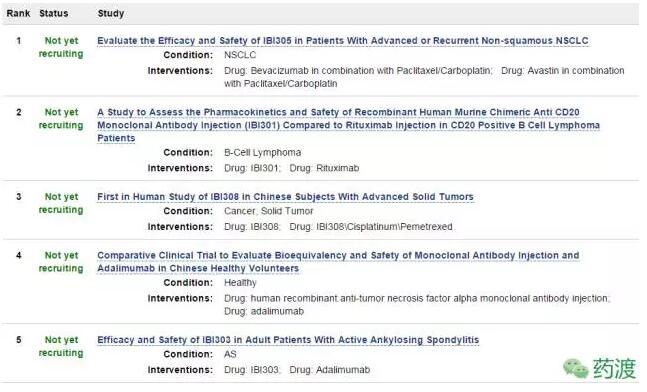
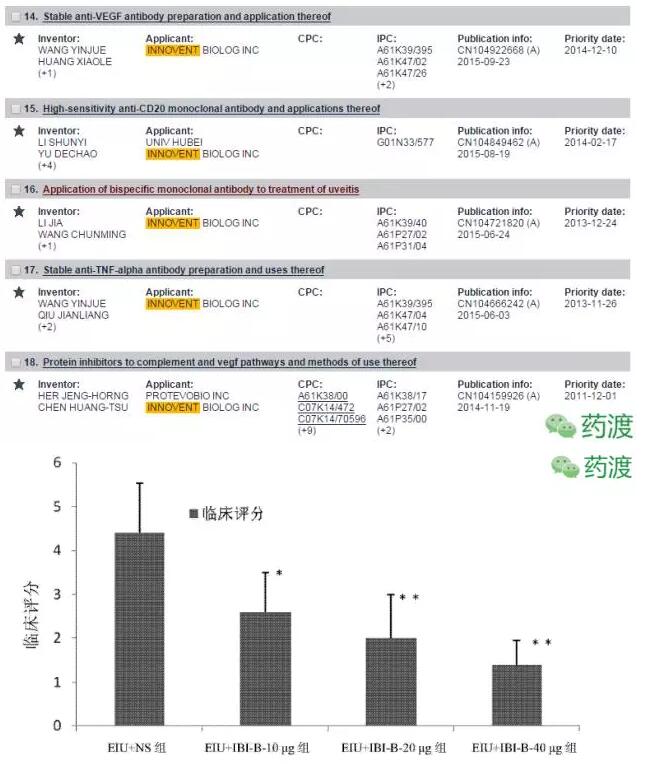
(6)从欧洲专利局查到,此前有一项双特异性单克隆抗体在治疗葡萄膜炎中的用途的专利。此抗体为施用于玻璃体的眼用注射剂。本发明的多肽能显著降低葡萄膜炎模型中的IL-1β、IL-6以及TNF-α等炎症因子,为治疗葡萄膜炎提供新的选择。
(1)2015年3月和10月,信达生物与礼来制药达成两次总金额达33亿美元的全面战略合作(涉及项目有IBI301/IBI308/双特异抗体(以PD-1单抗为基础)等);据悉信达生物目前从礼来制药拿到了7000万美元里程金;

(2)与Adimab、Aragen、Epimab等达成战略合作。
信达的开发模式,既有生物类似药,又有生物创新药。在日趋走向正规的国内医药市场中,高质量将是占领市场的必备法器。信达生物在俞博士的带领下,走在了国内生物制药的前列,继康柏西普之后,下一个推向市场的将是哪款呢?

 会员动态
会员动态
 中国医药创新促进会
中国医药创新促进会  2025-05-26
2025-05-26
 212
212

 会员动态
会员动态
 中国医药创新促进会
中国医药创新促进会  2025-05-19
2025-05-19
 265
265
 会员动态
会员动态
 北海康成
北海康成  2025-05-17
2025-05-17
 313
313