 会员动态
会员动态
 2014-12-22
2014-12-22
 6598
6598
来源:咸达数据 2014-12-22
1在审批
26个在审批的药物中,23个化药,3个治疗用生物制品,化药信息如下:
图1:在审批化药注册分类
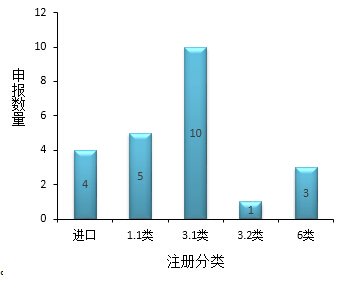
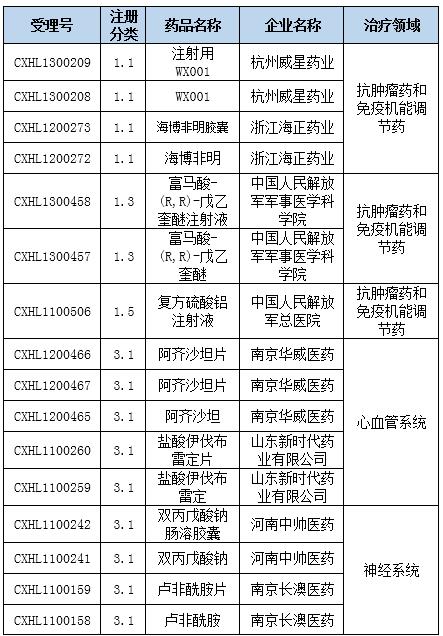
表1:在审批化药信息
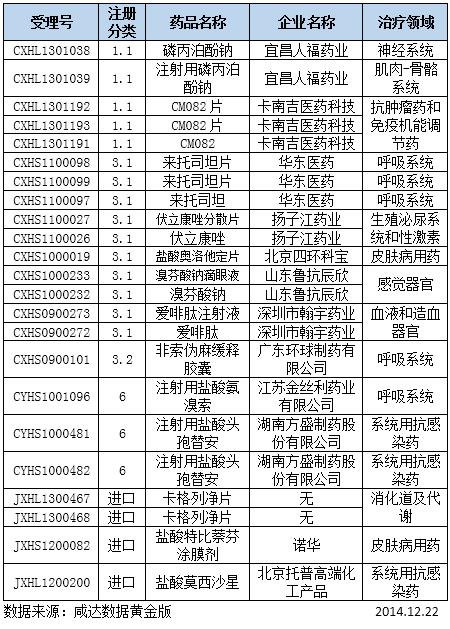
磷丙泊酚钠于2008年12月12日由FDA批准上市,商品名为Luse-dra,目前已经撤市。该药是由卫材公司研发,是一种小水针,临床上用作成年患者进行诊断或治疗操作过程的镇静催眠剂。磷丙泊酚钠是丙泊酚的一种水溶性的前体药物,该前药静脉注射给药后在体内被内皮细胞表面的碱性磷酸酶代谢产生活性药物丙泊酚,其在大脑组织内迅速达到平衡,从而发挥剂量依赖性的镇静催眠作用。2010年卫材在中国进行磷丙泊酚钠注射液进口申报,但是2011年企业主动撤回,具体原因不详。
宜昌人福药业有限责任公司早在2008年初就对注射用磷丙泊酚钠进行1.1类申报,2009年获得临床批件,2013年再一次进行1.1类申报临床,目前处于审批阶段。此外,辽宁海思科制药有限公司却对本品进行3.1类申报,而陕西合成药业有限公司申报的注射用磷丙泊酚钠二水合物也是3.1类,目前都在排队审评。
卡南吉医药科技(上海)有限公司的CM082片属于受体酪氨酸激酶抑制剂类新型抗癌药的第三代产品。CM082目前进行的临床研究为抗肿瘤新药/抗眼底病变新药。卡南吉公司的合作伙伴美国艾科睿公司已经在美国进行了两年多CM082项目的临床试验,初步证实CM082达到甚至超过了预定目标,即在呈现对多种肿瘤良好的抑制作用的同时,对人只表现出极低的毒副作用。CM082片2013年3月第一次申报,同年6月被毙,同年底再一次申报,中间经历一次发补,目前已批准临床。
2审批完毕
46个审批完毕的药物均是化药,具体信息如下:
图2:审批完毕化药注册分类
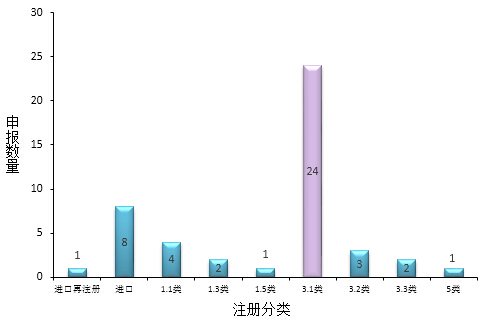
此次审批完毕的化药没有仿制,3.1类占大多数,这说明很多药企都在争相研制3.1类新药,对于仿制药没有之前那么热衷。
表2:审批完毕进口及进口再注册化药
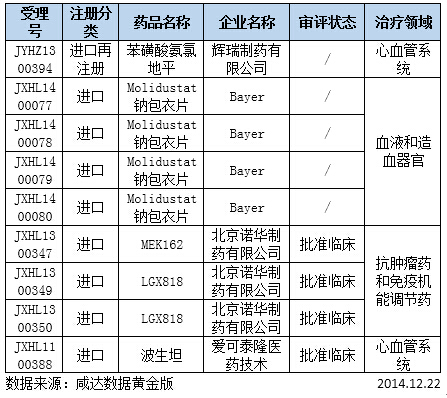
拜耳的Molidustat钠包衣片目前还在美国进行II期临床,此次在国内2014年3月申报,目前已经审批完毕,中间各项资料均未找到开始审批的时间,而且这个排队时间相对较短,推测本品应该是未批准临床。
表3:审批完毕的新药
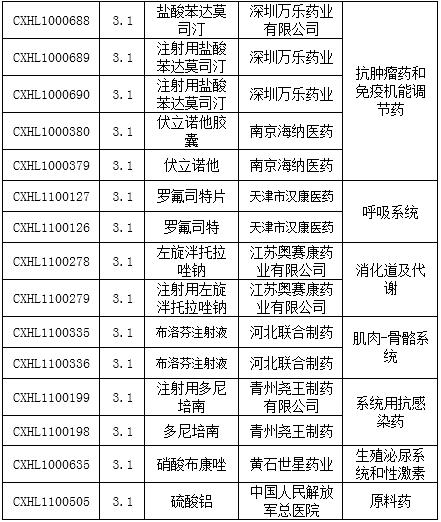
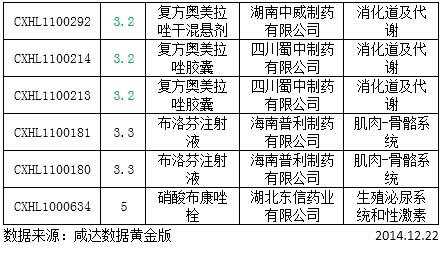
1.1类新药和1.3类新药的具体信息请参照审评周报18期,在这里不多叙述。3类申报大户罗氟司特片,阿齐沙坦片,布洛芬注射液又有厂家获批临床,至于这些药品后续的回报,还的各个企业的销售团队努力。小编大致看了这一批审批完毕的3类药物,基本都是2010年和2011年的(阿齐沙坦片2012年申报),3年获得临床批件,再进行生产的申报,等这些新药真正批产销售,也就真的不“新”了。
3制证完毕
40个制证完毕的药物,其中20个化药,19个中药,1个体外诊断试剂,化药的具体信息如下:
表4:制证完毕的化药
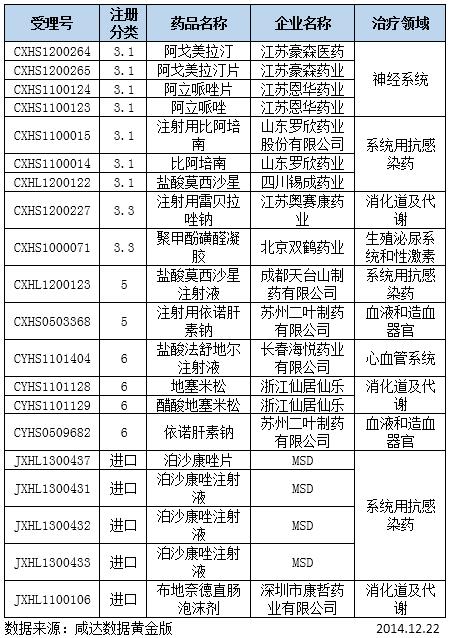
江苏豪森医药集团连云港宏创医药有限公司的阿戈美拉汀原料及其片剂已经制证完毕,应该是批准生产,豪森可以坐等证书了。注射用雷贝拉唑钠属于国外已上市国内未上市改变给药途径的药物,目前国内仅有1家企业在生产,目前江苏奥赛康药业股份有限公司申报的本品也已批准生产。而同样的3.3类药物聚甲酚磺醛凝胶目前也国内也只有1家上市,北京双鹤药业股份有限公司申报的本品推测获批。

 会员动态
会员动态
 Being科学
Being科学  2025-07-19
2025-07-19
 27
27

 会员动态
会员动态
 征祥医药
征祥医药  2025-07-19
2025-07-19
 38
38

 会员动态
会员动态
 瞪羚社
瞪羚社  2025-07-19
2025-07-19
 26
26