 研发追踪
研发追踪
 2015-04-03
2015-04-03
 5986
5986
来源:新康界/金伊 2015年04月03日
2015年03月份美国FDA共审批通过8种新药,1类新分子实体药物2个;新生物药物2个;3类新剂型药物1个;;5类新规格或新生厂商药物2个;新生物仿制药1个。
2015年03月份美国FDA审批通过新药
2015年3月美国FDA审批通过一个新分子实体药物,为日本第一三共公司研发的抗凝血新分子实体药物Savaysa(Edoxaban);审批通过二个新生物药物,为诺华公司研发的银屑病新生物药Cosentyx(Secukinumab)和NPS 制药研发的甲状旁腺机能减退新生物药 Natpara(重组人甲状旁腺激素)。同时还有一个有意义的审批药物是AbbVie公司研发的3类新剂型药物Duopa,用于帕金森病的治疗。Duopa是卡比多巴/左旋多巴组成的混悬液,给药时需要利用CADD-Legacy? 1400 泵将药物直接输注进小肠,从而避免胃酸对药物的降解。
表12015年03月份美国FDA审批通过新药
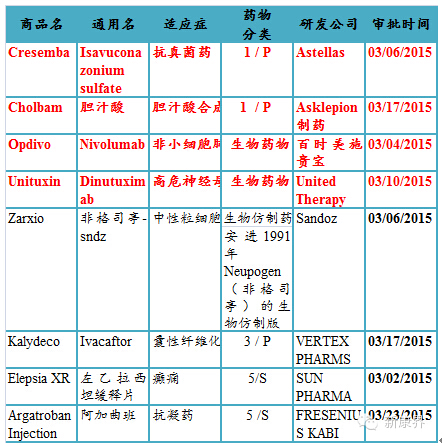
注:1)化学新药分类:1类新分子实体化合物;3类新剂型; 5类药物新 规格或新生产商;
2)审批分类:P优先评审;S常规评审
(一)抗真菌新分子实体药物Cresemba(Isavuconazonium sulfate)
2015年03月06日,美国FDA优先审批批准Astellas公司研发的抗真菌新分子实体药物Cresemba(Isavuconazonium sulfate/艾沙康唑硫酸盐)上市,用于治疗侵入性曲霉病和毛霉菌病。Cresemba(艾沙康唑硫酸盐)是艾沙康唑的前提药物,进入体内后代谢为艾沙康唑进而发挥抗真菌的作用。Cresemba共有口服和注射两种剂型,Cresemba口服胶囊含有186mg艾沙康唑硫酸盐, Cresemba注射剂含有372mg艾沙康唑硫酸盐。
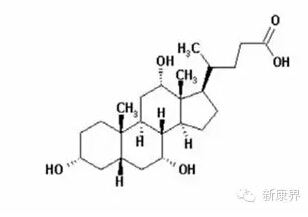
(二)胆汁酸合成障碍新分子实体药物Cholbam
2015年031月17日,美国FDA批准Asklepion制药公司研发的胆汁酸合成障碍新分子实体药物Cholbam上市。Cholbam是一种胆汁酸,用于治疗因单一酶缺乏而导致胆汁酸合成障碍的儿科及成年患者及用于过氧化物酶体病(包括齐薇格谱系障碍)。患有这些罕见疾病的患者体内缺乏用来合成胆酸的酶,胆酸的缺乏导致胆汁流量减少,从而致使有毒的胆汁酸中间体潜在积聚于肝脏内(胆汁阻塞)及对饮食中的脂肪和脂溶性维生素吸收不良。如果不进行治疗,患者将不能生长,并会发生危及生命的肝损伤。Cholbam为口服胶囊剂型,共有50mg和250mg两种规格。

(三)非小细胞肺癌新生物药 Opdivo (Nivolumab)
2015年03月04日,美国FDA批准百时美施贵宝研发的新生物药Opdivo(Nivolumab)用于治疗化疗后仍恶化的转移性鳞状非小细胞肺癌的治疗。Opdivo(Nivolumab) 为人源化单克隆抗体,是PD-1(programmed death 1,程序性死亡-1受体) 抑制剂类药物,最早于2014年12月03日通过美国FDA审批用于的黑色素瘤的治疗。
(四)高危神经母细胞瘤新生物药Unituxin (Dinutuximab)
2015年03月10日,美国FDA批准United Therapy公司研发的高危神经母细胞瘤新生物药Unituxin (Dinutuximab)上市。神经母细胞瘤是一种罕见的癌症,它形成于不成熟的神经细胞。这种疾病通常起始于肾上腺,但还可能在腹部、胸部或脊柱附近的神经组织发展。神经母细胞瘤通常发生在五岁以下的儿童身上。Unituxin (Dinutuximab)是一种GD2-结合单克隆抗体,临床上与粒细胞-巨噬细胞集落刺激因子(GM-CSF)、白介素-2(IL-2)、13-顺-视黄酸(RA)联用。Unituxin (Dinutuximab)被批准用作综合治疗方案的一部分,包括手术、化疗及放射治疗,适用于对之前一线多种药物、综合治疗至少达到部分响应的患者。
附:美国FDA审批新药说明
美国FDA审批新药主要是根据药物化学类型和治疗潜能来进行分类的。新药按化学类型主要分为:1类新分子实体化合物(NME),创新性最强。指在美国从未作为药品批准或销售的活性成分,可以是单一成分,也可以是立体异构混合物中的一部分;2类新的衍生物。从已上市的活性成分(即所谓“专利”药)化学衍生而来,即已在美国上市的活性成分的酯、盐或其它非共价键衍生物,或者是去修饰基团的母体化合物未在美国批准上市的;3类新剂型。含有已上市活性成分的新剂型或新处方,其适应症可以与上市产品相同,也可以不同;4类新组合物。含有两种或两种以上已上市的活性成分的品种,上市产品中尚无这种组合;5类药物新规格或新生产商;6类新适应症。由同一家公司或其他公司在美国批准或上市的具有新用途的复制品;7类已上市但未经NDA批准的药品。适应症已与上市产品相同,也可不同;8类变为非处方药;10类适应症不同的新的新药申请。
治疗潜能类分P类和S类两种,是相互独立的两类,即所有的分类中只能包含其中的一个字母。P类:优先评审,治疗上有突破。指1)能有效地治疗或诊断某种疾病,而任何上市产品能给予这种病适当的治疗和诊断;或2)较上市产品更有效、更安全地改善某种疾病的治疗;3)具有适中的、客观的超过上市药品的优越性。如①明显给病人带来较大方便(如减少给药次数),②消除干扰、必要的危险和副作用,③对特定的人群组疾病有效(如老年和儿童病人,或对已用过的药不能耐受的)等。S类:常规评审。治疗效果类似已上市的产品。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 337
337

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 326
326

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 315
315