 产业资讯
产业资讯
 米内网
米内网  2019-04-11
2019-04-11
 4727
4727
精彩内容
日前,中国生物制药发布2018年年报,公司实现营业收入约208.89亿元,同比去年增长约41.0%,归母净利润约90.46亿元,同比去年增长约316.7%。在产品方面,2018年公司33个产品年销过亿,未来5年过亿产品将超过50个;在研发方面,2018年公司研发投入20.91亿元,18个新品获批生产,目前已有21个1类新药获批临床,生物类似药、PD-L1等均取得不错进展;在一致性评价方面,公司已有6个品种通过或视同通过一致性评价,在审的18个品种中11个有望首家过评,公司认为,第二批“4+7”带量采购入选品种预计将在今年夏天公布,并在今年年底执行,预计第二批带量采购会带来利好。
4大产品年销超10亿,抗肿瘤板块“崛起”
3月31日,中国生物制药发布2018年年报,公司实现营业收入约208.89亿元,同比去年增长约41.0%;归母净利润约90.46亿元,同比去年增长约316.7%;截至报告期末,公司现金及银行结余约66.76亿元。
图1:中国生物制药板块收入TOP5

(来源:上市公司年报)
2018年肝病用药仍然是中国生物制药收入的主要来源,但是该板块销售收入占总营收比重同比去年大幅下降;抗肿瘤用药销售收入增长强劲,同比去年增长99.6%,占总营收比重提升至15.3%,成为公司收入的第二大来源。
2018年5月,公司自主研发的1.1类创新药安罗替尼获批上市,之后通过谈判降价纳入国家医保,放量可期,目前该产品针对多个肿瘤适应症的临床试验正在广泛开展,未来或将呈现持续爆发性增长。此外,多西他赛注射液、注射用硼替佐米、来那度按胶囊等抗肿瘤药也于2018年获批上市,进一步丰富了公司抗肿瘤产品线,未来该板块销售收入将持续提升。
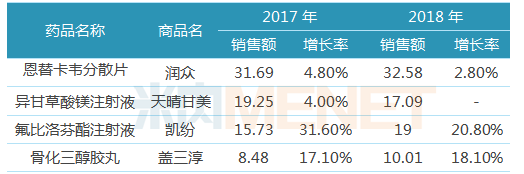
表1:2018年中国生物制药年销超过10亿元的品种(单位:亿元)
(来源:上市公司年报)
2018年中国生物制药有33个产品年销超过1亿元(同比去年增加1个),其中销售额在10亿~40亿元的品种有4个(与去年持平),销售额在5亿~10亿元的品种有8个(同比去年增加4个),销售额在3亿~5亿元的品种有5个,销售额在1亿~3亿元的品种有16个。中国生物制药表示,预计未来五年销售额超过1亿元的药品数量将超过50个。
从销售收入看,润众(恩替卡韦分散片)作为中国生物制药的拳头产品,多年蝉联销售冠军宝座,盖三淳(骨化三醇胶丸)近几年来保持着较快的增长速度,2017年销售收入8.48亿元,2018年销售收入突破10亿元。
从产品增速看,2018年公司有13个产品销售收入增速超过20%,其中依固(唑来膦酸注射液)、得百安(氟比洛芬巴布膏)、艾速平(艾司奥美拉唑注射液)、赛维健(雷替曲康注射液)、依尼舒(达沙替尼片)增速分别为82.4%、73.1%、59.9%、53.5%、51.3%。
6个品种已过评,11个品种有望首家过评
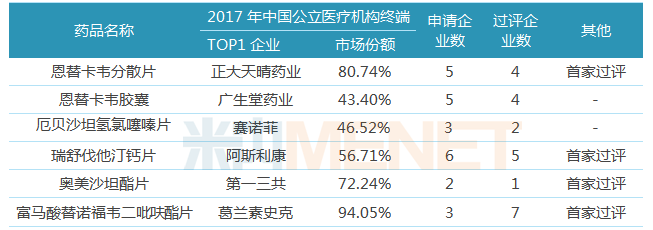
表2:中国生物制药通过或视同通过一致性评价品种
(来源:米内网数据库、上市公司公告)
截至4月4日,中国生物制药共有6个受理号(6个品种)通过或视同通过一致性评价,其中有4个品种为首家过评。从适应症看,丙肝用药、降压药、降血脂药品种数分别为3个、2个、1个。
润众(恩替卡韦分散片)是中国生物制药的拳头产品,在2017年中国公立医疗机构终端恩替卡韦片剂的竞争格局中,正大天晴药业的恩替卡韦分散片以80.74%的市场份额位居首位,该产品通过一致性评价,有利于巩固公司在肝病领域的龙头地位。在首批“4+7”国家带量采购中,正大天晴的恩替卡韦以超过90%的降幅中选,长期看该产品的利润贡献有下滑的趋势,但中短期仍可作为公司贡献现金流的重点产品。
晴众(富马酸替诺福韦二吡呋酯片)按仿制4类申报上市,获批生产后视同通过一致性评价,该产品是首个按照一致性评价标准完成生物等效性研究的仿制药,中国生物制药首家过评;托妥(瑞舒伐他汀钙片)在降血脂的应用仅次于阿托伐他汀钙片。晴众、托妥这2个品种在2017年中国公立医疗机构终端竞争格局中,原研厂家均占据较高市场份额,中国生物制药的产品通过一致性评价,有利于实现仿制替代原研。
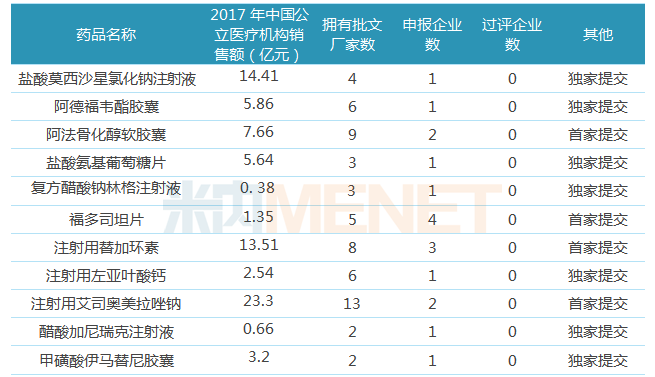
表3:中国生物制药有望首家通过一致性评价品种
(来源:米内网数据库)
截至目前,中国生物制药获得CDE承办的一致性评价补充申请受理号共35个(涉及23个品种),其中有5个受理号(涉及5个品种)已顺利通过一致性评价,此外还有30个受理号(涉及18个品种)还未有审评结论。18个品种中有11个品种由中国生物制药独家或首家提交一致性评价补充申请,有望首家通过一致性评价。
4月1日,中国生物制药执行董事兼副总裁谢炘在业绩发布会上表示,第二批“4+7”带量采购入选品种预计将在今年夏天公布,并在今年年底执行。公司在第二批带量采购所涉及的主要产品应该会比第一批少,加上公司有些产品刚通过一次性评价,有较大机会中标,因此预计第二批带量采购会利好公司。
然而就在3月27日,江西新余市卫健委发布通知称,因涉及违规行为,从即日起取消中国生物制药子公司正大天晴药业集团部分产品在该市公立医院的销售资格,被取消销售资格的药品就包括了首批“4+7”带量采购中选品种--恩替卡韦分散片,这为公司下一步开展国家带量采购蒙上阴影。
2大吸入剂挑战原研,生物药步入收获期
据中国生物制药年报数据,近几年来公司研发投入节节攀升,2018年研发投入约20.91亿元,同比去年增长约31%,占总营业收入比重约10%,在国内已公布财报上市药企中排在第四位(百济神州6.79亿美元,恒瑞医药26.7亿元,复星医药25.07亿元)。
报告期内,中国生物制药有18个产品获批生产,包括1类新药盐酸安罗替尼胶囊、首仿品种醋酸加尼瑞克注射液、获得4年新药监测期的利多卡因凝胶膏、最新第四代产品复方醋酸钠林格注射液等,公司预计未来五年每年都有10~15个产品获批上市;有23个产品获批临床,其中18个为1.1类新药,2个为生物类似药。
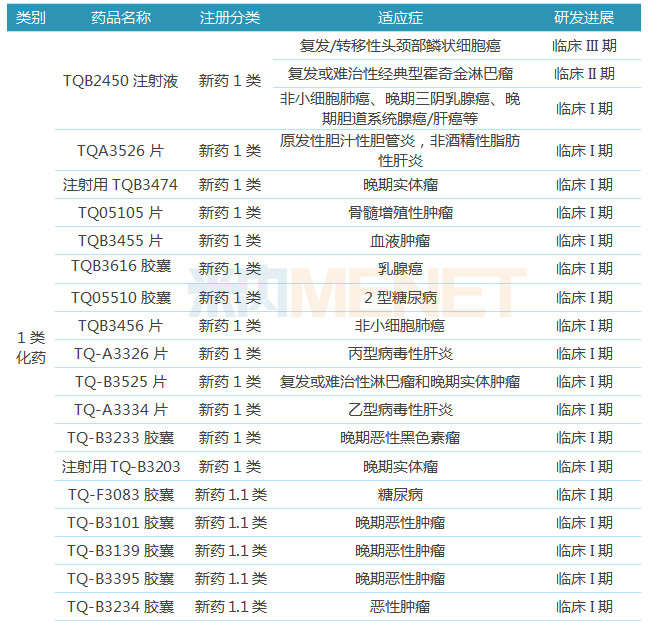
表4:中国生物制药开展临床研究的创新药
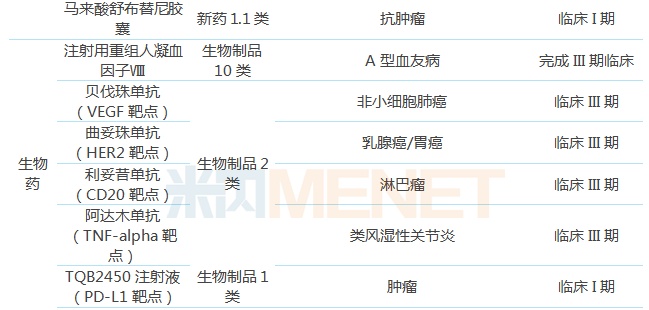
(来源:米内网数据库)
2018年5月,中国生物制药子公司正大天晴自主研发的1类新药盐酸安罗替尼胶囊获批上市,标志着公司正式由“仿创结合”走向“创仿结合”,创新药将成为公司未来的发展动力。据米内网数据库,中国生物制药申报创新药数量在全国处于领先地位,截至目前,公司获批临床的1类新药有21个(不包括已上市品种),其中有19个正在开展临床I期试验,TQB2450注射液(复发/转移性头颈部鳞状细胞癌)已进行到临床III期。
中国生物制药在生物药领域的布局起步较晚,但公司凭借着强大的临床能力,实现了临床进度的赶超。截至目前,公司已有8个生物药处于临床试验阶段,注射用重组人凝血因子VIII即将报产,预计2019年获批;4个重磅生物类似物进入III期临床,创新生物药TQB2450注射液(PD-L1)进入I期临床。公司的生物药管线将于2020年左右进入收获期。
表5:中国生物制药有望斩获首仿的吸入剂
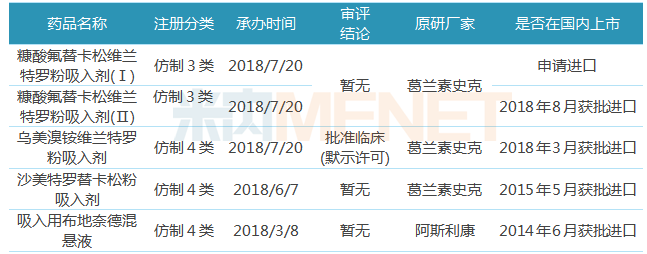
(来源:米内网数据库、上市公司公告)
目前国内的吸入剂市场基本被外资垄断,中国生物制药在该领域的研发处于领先地位,沙美特罗替卡松粉吸入剂、吸入用布地奈德混悬液有望在2019年首仿上市。
沙美特罗替卡松粉吸入剂适用于对哮喘进行常规治疗的患者的联合用药,据米内网数据,2017年中国公立医疗机构终端沙美特罗替卡松销售额为14.21亿元,该市场由原研厂家葛兰素史克垄断。目前国内有正大天晴、恒瑞医药针对沙美特罗替卡松粉吸入剂申报上市,正大天晴处于研发较快阶段。
吸入用布地奈德混悬液是一种吸入性糖皮质激素(ICS),为治疗哮喘的基础用药之一,也可作为慢阻肺的辅助用药。据米内网数据,2017年中国公立医疗机构终端布地奈德销售额为69.87亿元,目前上市销售的剂型有混悬剂、喷雾剂和气雾剂等,混悬剂的销售占比处于主导地位并不断上升,目前仅原研厂家阿斯利康销售吸入用布地奈德混悬液,在临床方面,正大天晴进展最快,其研发的混悬液已完成BE试验。
来源:米内网数据库、上市公司公告

 产业资讯
产业资讯
 新药说
新药说  2025-06-16
2025-06-16
 63
63

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-06-16
2025-06-16
 63
63

 产业资讯
产业资讯
 猎药人俱乐部
猎药人俱乐部  2025-06-16
2025-06-16
 67
67