 研发追踪
研发追踪
 2014-12-17
2014-12-17
 5255
5255
来源:浮米网 2014-12-17
从获得突破性疗法认证的药物分类来看,第一类还是抗肿瘤药物,占42%,去年此类药物占46%。其次是抗感染类药物占19%,比去年15%略微上升。
自2013年11月至今,各制药公司已公开31个突破性药物,其中包括小分子化合物,单抗和双抗药物,干细胞药物以及疫苗。
表12013年11月后公开的突破性药物目录
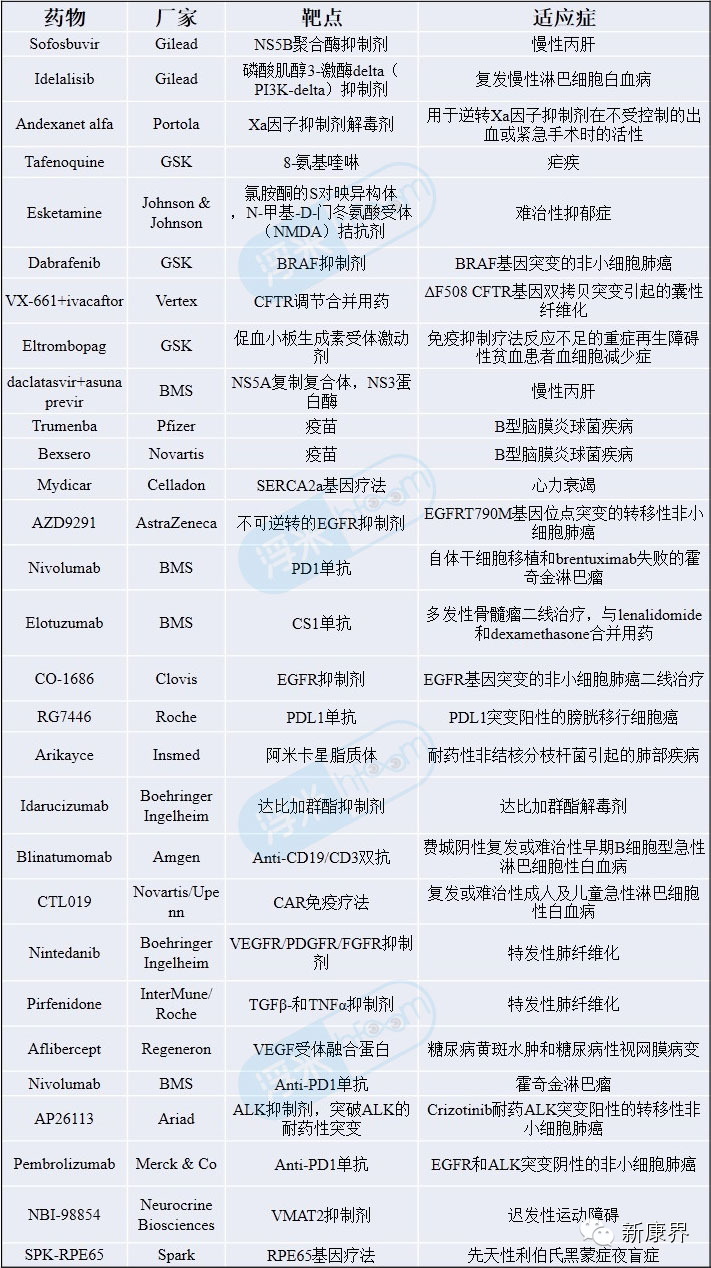
自11月6日起,美国药品评价研究中心(CDER)以及美国生物药品评价研究中心(CBER)已接受244项突破性药物资格申请,其中CDER授予61项,驳回101项,CBER授予7项,驳回27项。
图12013年11月后已公开的突破性药物的治疗领域分类
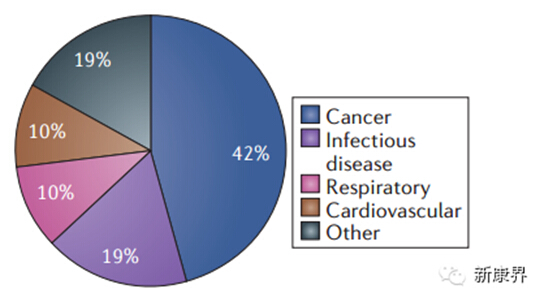
第一类突破性药物为抗肿瘤药物,占42%,去年此类药物占46%。自该项目开始,非小细胞肺癌药物共有7个药物获得认证最受瞩目,包括3个治疗ALK阳性突变的非小细胞肺癌药物。
抗感染类药物占19%,比去年15%略微上升,相较于去年全部是抗丙肝病毒药物,今年新增有抗疟疾药物,抗脑膜炎球菌药物以及抗非结核分枝杆菌肺部疾病药物。
呼吸系统以及心血管系统药物各占10%,包括后来认证的治疗囊性纤维化药物。
从公司层面分析,Novartis和BMS自该项目开始各有5个获得认证的突破性药物,大型制药公司和生物技术公司约占全部获认证突破性药物的70%。
此外,5月FDA接受其独立咨询委员会意见,拒绝批准诺华心衰试验药物 Serelaxin;10月,BMS放弃继续研发dualdaclatasvir和asunaprevir合并用药治疗丙肝病毒;还有虽然Prosensa近期开始提交杜氏肌营养不良(DMD)治疗药物 Drisapersen上市申请,但GSK因为三期临床试验结果不理想,已经放弃该药物的相关研发。
尽管有了实际上突破性药物资格的存在,药物研发的速度也并没有得到大的提升,一些限速度步骤仍然存在,比如生物药的生产。同时,突破性药物资格面临的最大问题是如何对这些药物进行定价。因为有了这个资格后,FDA会帮助获得该资格的药物所在的公司进行研究,缩短开发时间,除了病人从中得利外,公司能够让药物早一些上市也使得他们能有更长专利期销售时间。那么在这种情况下,公司是否应该在定价上给予一些让步?不过这个问题还是留待政府与公司进行协商吧。
 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 361
361

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 351
351

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 339
339