 研发追踪
研发追踪
 2014-05-05
2014-05-05
 5206
5206
来源:E药脸谱网 2014-05-04
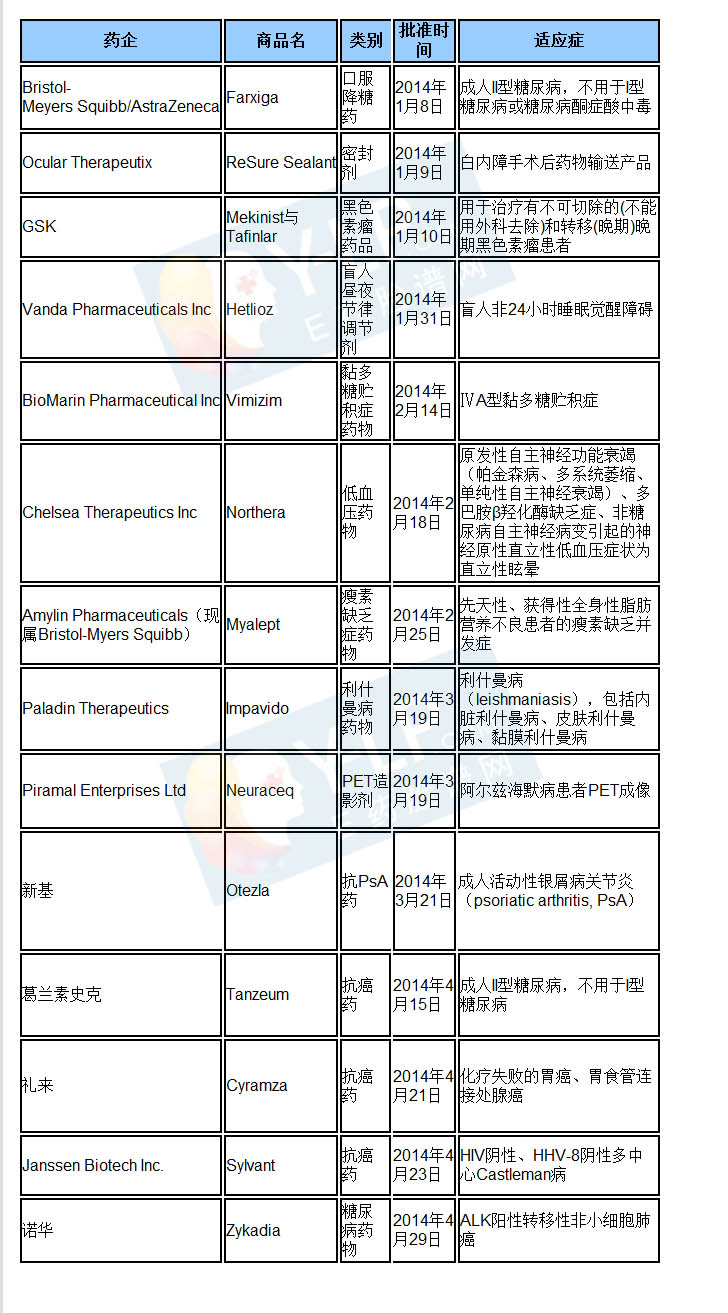
新药获得FDA批准的数量是衡量一家制药企业研发线效率的金标准,再加上新药的质量,就成为了目前所有大型跨国药企缓解“专利悬崖困境”最重要的解药。2013年FDA共批准通过了27个新药上市,虽然数量有所下降,但是业界普遍认为新药的质量在上升,分析认为有10个具有重磅炸弹的潜质。而其中更有Gilead的丙肝药物Sovaldi这样的神药,这个药物上市第一个季度就获得了22.7亿美元的销售神话。
2014年FDA在前4个月里,共批准了14个新药上市,其中GSK与BMS同样有两款新药获批,位列前茅。
【1月】
●阿斯利康口服降糖药Farxig获批
1月8日,阿斯利康的Farxiga (dapaglifozin)获得FDA批准,用于治疗成人II型糖尿病。Farxiga是FDA批准的第二个SGLT2抑制剂,原本是第一个向FDA递交上市申请的,但被要求补充临床数据,反而被卡格列净抢了头彩。
Farxiga的活性成分为达格列净,采用达格列净-山梨醇-水(1:1:1)合物,达格列净是SGLT2抑制剂,抑制肾小管葡萄糖重吸收,从而使血糖经尿液排出。
●Ocular Therapeutix白内障药品ReSure Sealant获批
1月9日,Ocular Therapeutix的ReSure Sealant获得FDA批准,ReSure Sealant是白内障手术后药物输送产品,这也是FDA唯一一个批准的密封剂产品。
ReSure Sealant是一种一种人工合成的聚乙二醇水凝胶,用于防止内障手术后伤口渗漏的液体流出,迄今为止,这种封口方式是封闭白内障手术后角膜伤口渗漏的唯一选择。
ReSure Sealant 试剂盒由两种液体溶液组成,医生将两种溶液混合后通过泡沫敷料器涂抹在伤口上。混合后的溶液在20秒后变为胶状物覆盖在切口上封闭创面并形成一个光滑的表面屏障。一周后胶状物渐渐碎裂并通过天然的眼泪清除出体内。
●GSK黑色素瘤药品Mekinist与Tafinlar获批
1月10日,GSK的Mekinist与Tafinlar获得FDA批准,用于治疗有不可切除的(不能用外科去除)和转移(晚期)晚期黑色素瘤患者。Mekinist和Tafinlar是被FDA批准联合治疗黑色素瘤的第一个药物。
Mekinist和Tafinlar被用于阻断相同分子通路的不同部位的信号促进癌细胞生长。它们特别适用作为联合治疗肿瘤表达基因突变被称为BRAF V600E和V600K黑色素瘤患者。BRAF蛋白质涉及在正常细胞生长中调节,但在约半数来自皮肤黑色素瘤突变。
●Vanda盲人昼夜节律调节剂Hetlioz获批
1月31日,Vanda Pharmaceuticals Inc的Hetlioz(tasimelteon)获得FDA批准,用于治疗盲人非24小时睡眠觉醒障碍。
Hetlioz的活性成分为他司美琼,他司美琼是褪黑激素受体激动剂,褪黑激素受体被认为与昼夜节律的控制有关,但该药的精确作用机制尚不明确。Hetlioz为胶囊,推荐剂量为20mg/天,睡前服用。
盲人由于缺乏光线刺激,某些患者的生物钟不能与昼夜节律同步,即非-24小时睡眠觉醒障碍,他司美琼是针对该类患者的第一个药物。
【2月】
●BioMarin黏多糖贮积症药物Vimizim获批
2月14日,BioMarin Pharmaceutical Inc的Vimizim(elosulfase alfa)获得FDA批准,用于ⅣA型黏多糖贮积症。
Vimizim的活性成分为elosulfase alfa,elosulfase alfa是一种通过DNA重组技术生产的酶。ⅣA型黏多糖贮积症是由于缺乏N-acetylgalactosamine-6 -sulfatase活性,不能有效地水解黏多糖,黏多糖蓄积而导致细胞、组织、器官损伤,elosulfase alfa作为酶替代疗法治疗该症。Vimizim为静脉注射剂,推荐剂量为2 mg/kg,每周一次。
Vimizim是FDA批准的首个ⅣA型黏多糖贮积症药物,美国有该症患者800例。该药定价为38万美元/年,分析师预测年销售额为4-5亿美元。
●Chelsea低血压药物Northera获批
2月18日,Chelsea Therapeutics Inc的Northera(droxidopa )获得FDA批准,主要用于原发性自主神经功能衰竭多巴胺β羟化酶缺乏症、非糖尿病自主神经病变引起的神经原性直立性低血压,症状为直立性眩晕。
Northera的活性成分为屈昔多巴,屈昔多巴是一种合成的氨基酸,在体内被多巴胺脱羧酶代谢成去甲肾上腺素,去甲肾上腺素能够升高血压。Northera为片剂推荐剂量为300 mg/天,分三次口服。
屈昔多巴最初由Sumitomo Pharmaceuticals(现属Dainippon Sumitomo)研发,1989年后在日本及亚洲其他地区获批,用于治疗神经原性直立性低血压、透析相关低血压,2006年Dainippon Sumitomo将日本、中国、韩国、台湾以外的权利许可给Chelsea Therapeutics。国内重庆圣华曦药业于2012年首仿(3+3)上市,商品名善为,目前尚无其他厂家申报。
●BMS瘦素缺乏症药物Myalept获批
2月25日,Amylin Pharmaceuticals(现属Bristol-Myers Squibb)的Myalept(metreleptin)获得FDA批准,用于先天性、获得性全身性脂肪营养不良患者的瘦素缺乏并发症。此外,Myalept是首个治疗该症的药物。
Myalept的活性成分为美曲普汀。美曲普汀是一种重组人瘦素类似物,由147个氨基酸构成,Cys-97与Cys-147之间有二硫键,分子量约为16.15 kDa。Myalept是注射剂,是瘦素类似物,能与瘦素受体结合,作为替代疗法治疗该症。
【3月】
●Paladin Therapeutics利什曼病药物Impavido获批
3月19日,Paladin Therapeutics的Impavido(miltefosine)获得FDA批准,用来适应利什曼病,包括内脏利什曼病、皮肤利什曼病、黏膜利什曼病。
Impavido的活性成分为米替福新。米替福新是一种抗利什曼虫药物,具体作用机制未明。Impavido为胶囊剂,50 mg/粒。胚胎-胎儿毒性,妊娠患者禁用。
●Piramal PET造影剂Neuraceq获批
3月19日,Piramal Enterprises Ltd的Neuraceq (florbetaben F18 )获得FDA批准,用于阿尔兹海默病患者PET成像。
Neuraceq 的活性成分为florbetaben F18。flutemetamol F18是一种F18标记的1,2-二苯乙烯衍生物,能够与脑部的β-淀粉样蛋白斑结合,产生能够被PET扫描检测到的正电子信号。
Neuraceq (florbetaben F18)是FDA批准的第三个淀粉样蛋白斑诊断试剂,之前还批准了Vizamyl (flutemetamol F18)、Amyvid (florbetapir F18),florbetaben F18与flutemetamol F18属于同类化合物。
● 新基抗PsA药Otezla获批
3月21日,新基医药Otezla(apremilast)获得FDA批准,用于治疗成人活动性银屑病关节炎(psoriatic arthritis, PsA)。apremilast是FDA批准的首个PDE4抑制剂。
Otezla其活性成分为apremilast,apremilast是PDE4抑制剂,阻止PDE4降解cAMP,治疗PsA的具体作用机制未明。Otezla为片剂,有10 mg、20 mg、30 mg三个规格。EvaluatePharma预测Otezla2018年销售额为12.19亿美元。
【4月】
●GSK糖尿病药阿必鲁肽获批
4月15日,GSK的阿必鲁肽(Tanzeum)获得FDA批准,用于成人II型糖尿病患者的治疗。阿必鲁肽是FDA批准的第二个长效GLP-1类似物,之前,FDA还批准了缓释艾塞那肽Bydureon。
阿必鲁肽,为GLP-1-HSA融合蛋白,是一种长效GLP-1类似物,能够激动GLP-1受体,促进胰岛素分泌从而降低血糖。阿必鲁肽是皮下注射剂,每周注射一次。主要适应于成人II型糖尿病,不用于I型糖尿病,可以单用,也可以与胰岛素、二甲双胍、格列美脲、吡格列酮联用。
●礼来抗癌药雷莫芦单抗获批
4月21日,礼来的雷莫芦单抗(Cyramza)获得FDA批准,用于化疗失败的胃癌、胃食管连接处腺癌患者。
ramucirumab是一种全人源anti-VEGFR2单抗,阻止VEGF与VEGFR2结合,产生抗血管生成作用。该产品为注射液,每2周输液一次。
ramucirumab是FDA批准的首个用于胃癌化疗失败后药物,由于大部分胃癌患者在中国,且该药延长的生存期只有1.4个月,EvaluatePharma预测2018年销售额为6.84亿美元。
●强生抗癌药Sylvant获批
4月23日,Janssen Biotech Inc.的Sylvant获得FDA批准,Sylvant是FDA批准的首个Castleman病治疗药物。
Sylvant为静脉注射剂,活性成分为siltuximab,siltuximab是一种嵌合型anti-IL-6单抗,IL-6介导多种生理功能,如诱导免疫球蛋白的分泌,Castleman病的全身性症状与过度产生IL-6有关。Sylvant用于HIV阴性、HHV-8阴性多中心Castleman病(一种类似淋巴瘤的罕见病)。
●诺华抗癌药Zykadia获批
4月29日,诺华的Zykadia获得FDA批准,Zykadia用于ALK阳性转移性非小细胞肺癌。Zykadia胶囊剂,剂量为750 mg/天。其活性成分为ceritinib,ceritinib是ALK抑制剂,对表达EML4-ALK、NPM-ALK融合蛋白的细胞有抑制作用,能够克服crizotinib耐药性。
ceritinib是FDA批准的第二个ALK抑制剂,作为ALK阳性非小细胞肺癌特效药,用于crizotinib耐药或不耐受的患者。这是FDA批准的第3个突破性药物,也是继ibrutinib后第二个经四重特批通道上市的药物。

 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-04-28
2025-04-28
 299
299

 研发追踪
研发追踪
 细胞基因治疗前沿
细胞基因治疗前沿  2025-04-28
2025-04-28
 301
301

 研发追踪
研发追踪
 药视点
药视点  2025-04-28
2025-04-28
 307
307