 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-04-28
2025-04-28
 4769
4769
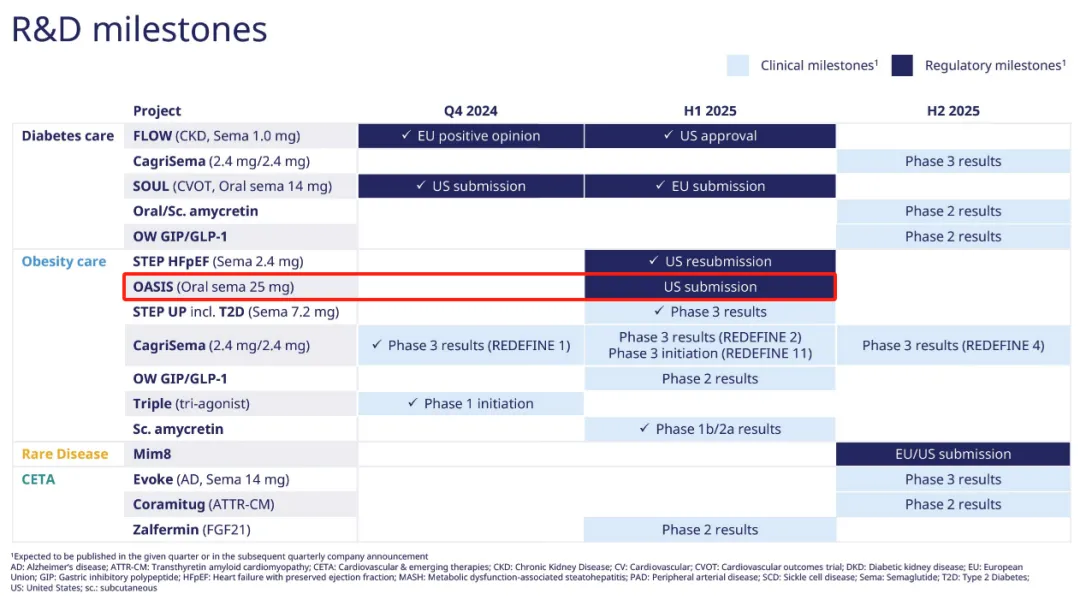
4月22日,据FirstWord Pharma报道,诺和诺德已向FDA提交申请,寻求批准其GLP-1受体激动剂司美格鲁肽口服版本用于减重。

诺和诺德指出,“今年年初
”已提交用于超重和肥胖症的口服司美格鲁肽25mg的申请,这与2024Q4财报中里程碑事件预计发生的时间相吻合。诺和诺德还表示,该申请代表
“GLP-1在口服减肥药中的首次应用和潜在批准”;并将在5月7日发布2025Q1财报时提供更多细节,包括FDA做出决定的时间。
几天前,礼来宣布其用于体重控制的口服GLP-1药物orforglipron的首项III期研究成功,
并预计将在今年年底前向全球监管机构提交orforglipron用于体重管理的申请。
诺和诺德则在更早前,即公布2024年H1业绩时透露,口服司美格鲁肽25mg的减重III期OASIS 4研究已成功完成。
该研究共纳入了307例体重指数(BMI)≥27kg/m2且伴有至少一种体重相关并发症(高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病)或BMI≥30kg/m2的超重或肥胖成人受试者,评估了口服司美格鲁肽(25mg,每日1次)与安慰剂的减重效果和安全性。研究持续72周,包括1周筛选期、64周治疗期和7周随访期。
口服司美格鲁肽组受试者在64周内按照剂量递增的方式接受治疗,其中第0-4周服用3mg剂量,第5-8服用7mg剂量,第9-12周服用14mg剂量,第13-64周服用25mg剂量。研究的主要终点为治疗期内受试者的体重相对于基线的百分比变化和体重下降至少5%的受试者数量。
受试者的体重基线为105.9kg。结果显示,口服司美格鲁肽组受试者的体重下降了13.6%,而安慰剂组这一比例为2.2%。如果所有受试者均坚持完成了治疗,则口服司美格鲁肽组的体重降幅为16.6%,安慰剂组降幅为2.7%。此外,在研究中,口服司美格鲁肽显示出了良好的安全性和耐受性。
原文:
https://www.biopharmadive.com/news/novo-oral-semaglutide-fda-approval-application-obesity/745882/

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 53
53

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 49
49

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 46
46