 产业资讯
产业资讯
 GBIHealth
GBIHealth  2021-08-17
2021-08-17
 4221
4221
百济神州2021Q2总营收1.5亿美元,
产品收入较去年同期增长111%;
再鼎医药2021Q2产品收入同比增长235%;
和黄医药上半年收入同比增长47%,产品欧美上市进程加快
......
近期,国内药企也相继公布上半年“成绩单”,GBI根据公司公布的财报和电话会议,对百济神州、再鼎医药、和黄医药报告期财务业绩、产品亮点、业务进展等进行概述,供大家参考。
BeiGene
百济神州Q2
产品收入增长111%

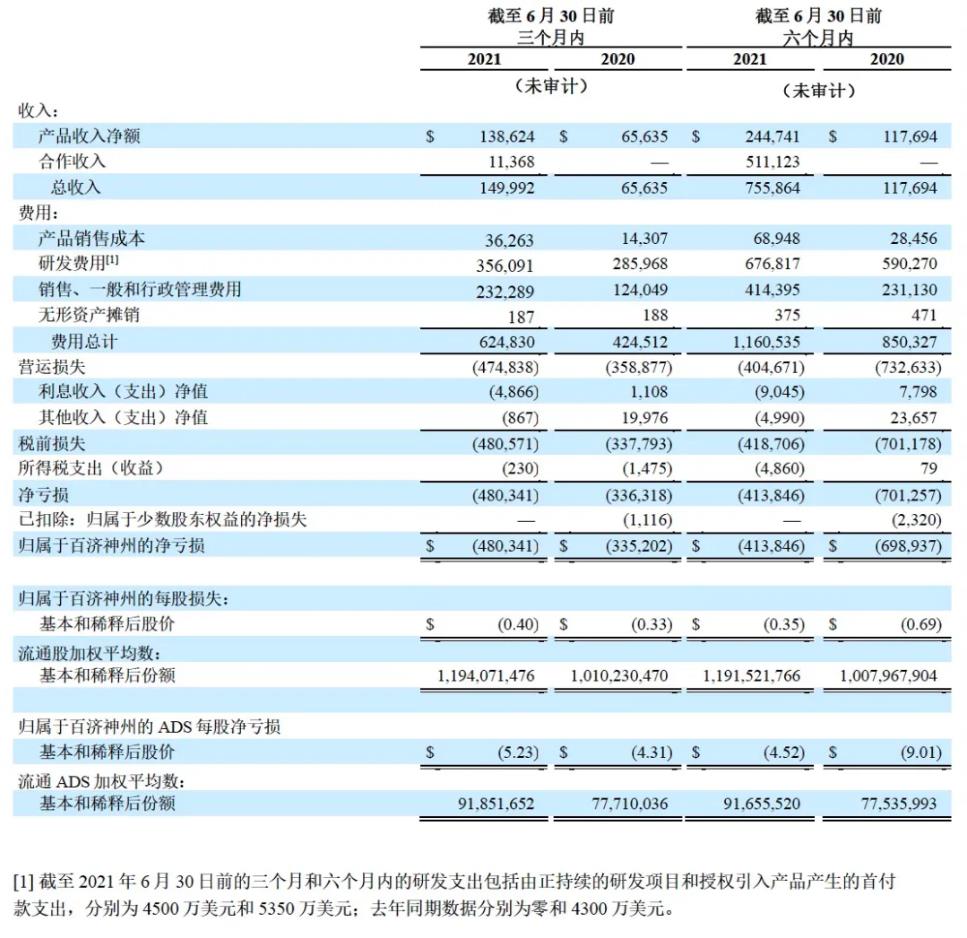
近日,百济神州发布2021年第二季度及上半年财务业绩,并披露了近期业务亮点和预计里程碑事件。2021年第二季度,百济神州总营收1.5亿美元,其中产品收入共计1.386亿美元,相较去年同期的0.656亿美元增长了111%。百泽安中国销售额7490万美元(去年同期2940万美元),百悦泽销售额4240万美元(去年同期700万美元),今年5月刚上市销售的百汇泽销售额已达220万美元。报告期内总支出6.248亿美元,研发支出为3.561亿美元(去年同期2.86亿美元)。
来源:百济神州财报
产品亮点
自百泽安(替雷利珠单抗)、百悦泽(泽布替尼)以及安加维(地舒单抗)纳入医保以来,第二季度医院进院数量显著增加,分别达到纳入医保前的约13倍、28倍和23倍。
报告期内,PARP抑制剂百汇泽(帕米帕利)获国家药监局附条件批准,用于既往接受过至少两线化疗、伴有胚系BRCA(gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。与安进合作的凯洛斯(注射用卡非佐米)获国家药监局附条件批准,联合地塞米松用于治疗既往至少接受过两种治疗(包括蛋白酶体抑制剂和免疫调节剂)的成年R/R多发性骨髓瘤患者。通过与诺华合作,PD-1药物百泽安(替雷利珠单抗)在中国以外递交首个新药上市许可申请。
企业发展
上海证券交易所科创板上市委员会批准了公司的上市申请。公司的普通股预计于2021年内在科创板上交易。
与Shoreline Biosciences签署了全球独家战略合作协议,联动Shoreline的iPSC NK 细胞技术与百济神州的临床前研发和临床开发能力,开发并商业化一系列基于NK细胞疗法的产品组合,用于治疗各类恶性肿瘤。
生产运营
宣布在新泽西州霍普韦尔(Hopewell)的普林斯顿西部创新园区建设新的生产和临床研发中心。百济神州已签署一项采购协议,收购一块面积约42英亩(约17万平方米)的场地,其中超过100万平方英尺(约9.3万平方米)为可开发地产。新基地在满足购买协议完成成交并获得当地批准后,预计于2023年建成。
ZaiLab
再鼎医药2021Q2
产品销售3690万美元

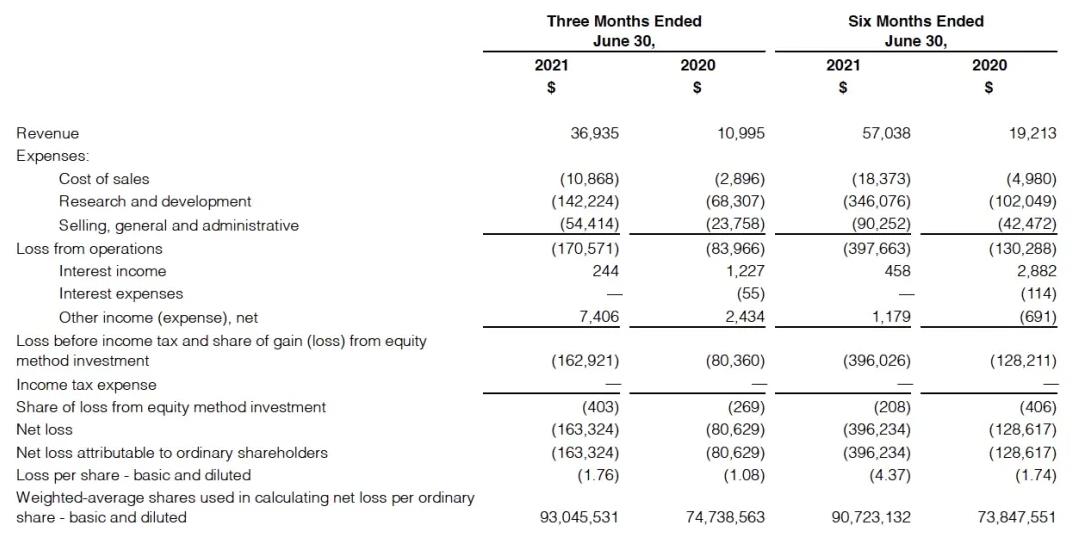
8月10日,再鼎医药有限公司公布截至2021年6月30日止3个月未经审核业绩。报告期内,产品收入为3690万美元,2020年同期收入为1100万美元。其中包括则乐(尼拉帕利)销售额2340万美元(2020年同期为750万美元),电疗产品爱普盾销售额950万美元(2020年同期为350万美元)和擎乐(瑞派替尼)销售额400万美元(2020年同期无收入)。
截至2021年6月30日止3个月的研发支出为1.422亿美元,2020年同期为6830万美元。研发开支的增加主要由于支付给Mirati公司的6500万美元预付款和支付给MacroGenics公司的2500万美元预付款,以及新增的研发开支。
来源:再鼎医药财报
报告期内产品亮点
则乐
于2021年3月1日国家医保药品目录(NRDL)实施当日至2021年6月30日的期间,则乐的进院数量为之前7倍,达到800余家。
爱普盾
在大中华区分别启动肿瘤电场治疗用于非小细胞肺癌的Ⅲ期关键性研究LUNAR和用于非小细胞肺癌脑转移的Ⅲ期关键研究METIS。
擎乐
2021年5月在中国上市,后续纳入两款城市普惠险。
Adagrasib
获美国FDA突破性疗法认定,用于治疗曾接受过全身治疗的KRASG12C突变非小细胞肺癌患者。
Odronextamab
再鼎医药合作伙伴再生元重启该分子潜在关键性Ⅱ期研究的滤泡性淋巴(FL)和弥漫性大B细胞淋巴瘤(DLBCL)患者入组。
Repotrectinib
在全球注册Ⅱ期TRIDENT-1研究中完成大中华区首批患者入组。
CLN-081
合作伙伴Cullinan公布CLN-081用于非小细胞肺癌EGFR外显子20插入突变患者的Ⅰ/Ⅱa期研究中期数据,总体安全耐受性良好,胃肠道毒性特征亦表现良好。
纽再乐
口服给药方案用于治疗社区获得性细菌性肺炎(CABP)成人患者的仿制药上市申请获美国FDA批准。
业务拓展
2021年6月,再鼎医药和MacroGenics宣布双方就四个免疫肿瘤分子达成独家合作和许可协议;和Mirati宣布,双方就小分子KRASG12C抑制剂adagrasib在大中华区达成合作和许可协议;2021年7月,再鼎医药和Schrödinger宣布了一项全球研发和商业化合作项目,专注于新型肿瘤DNA损伤修复。2021年9月,再鼎医药专注临床开发及商务事宜的办公室将在马萨诸塞州剑桥市开业。
和黄医药上半年
收入同比增长47%,产品欧美上市进程加快

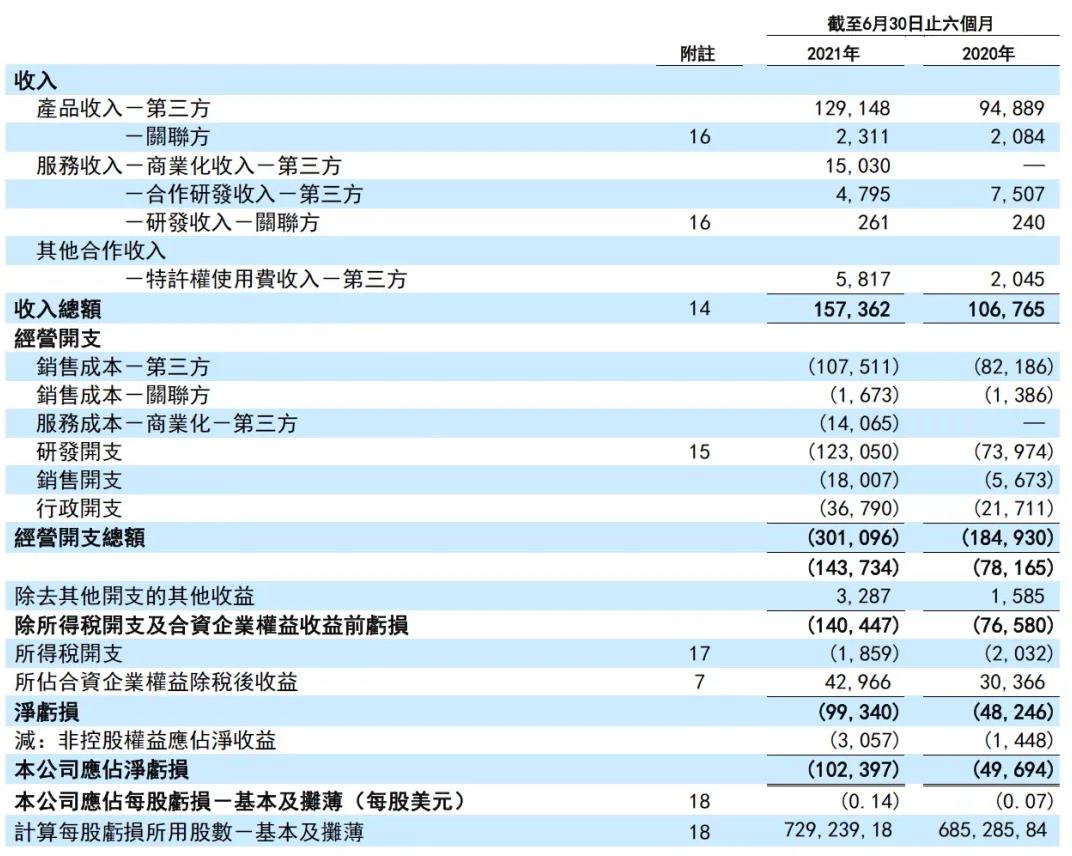
和黄医药(中国)有限公司公布2021年中期业绩及最新业务进展,其中在中国上市的新产品表现强劲。报告显示,和黄医药2021年上半年收入1.57亿美元,同比2020年同期的1.07亿美元增长47%。肿瘤/免疫业务综合收入为4290万美元,同比增长161%。目前在中国上市了三种完全自主研发的新药:爱优特(呋喹替尼),苏泰达(索凡替尼)和沃瑞沙(赛沃替尼)。爱优特贡献最大,其销售额同比增长186%,达到4010万美元。
来源:和黄医药财报
爱优特
一种高选择性的 VEGFR 1/2/3小分子抑制剂,于2018年9月获批用于结直肠癌的三线治疗,并于2020年初被纳入国家医保目录。和黄医药于2020年10月开始负责原本由合作伙伴礼来承担的爱优特在全中国的所有即场医学说明、推广以及本地和区域营销活动的发展与执行责任。其销售团队从2020年底的400人增加到目前的540人。
苏泰达
一种VEGFR 22、FGFR 23及CSF-1R 24的小分子抑制剂,于2021年1月中旬首次推出,用于治疗源自胰腺以外的晚期神经内分泌瘤。2021年上半年总销售额为800万美元。
沃瑞沙
首个在中国获批的同类选择性MET抑制剂。于2021年7月中旬,距离 NMPA 有条件批准其用于MET外显子14跳变的非小细胞肺癌患者后不到三周,沃瑞沙通过合作伙伴阿斯利康正式推出市场。和黄医药将获得销售额30%的特许权使用费。
全球业务进展
2021年6月,和黄医药完成向美国FDA提交苏泰达的新药上市申请(NDA),用于治疗胰腺及胰腺外神经内分泌瘤。拟定的处方药使用者付费法案(PDUFA)目标日期为2022年4月30日;2021年7月苏泰达的NDA在欧洲EMA获确认及受理,用于治疗胰腺及非胰腺神经内分泌瘤。爱优特和沃瑞沙在美国、欧盟和日本的注册试验也在进行中,预计爱优特将在 2023 年进入美国市场。和黄医药2021年上半年一共募集了12亿美元,包括香港上市获得的逾5亿美元。

 产业资讯
产业资讯
 丁香园Insight数据库
丁香园Insight数据库  2025-12-18
2025-12-18
 33
33

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-12-18
2025-12-18
 34
34

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-12-18
2025-12-18
 29
29