 产业资讯
产业资讯
 研发客研究院
研发客研究院  2021-08-24
2021-08-24
 2617
2617
中国医药市场掀起Licensing-in热潮的同时,国产创新药也在稳步推进中,虽多数还处于研发阶段,但已有部分步入了收获期、成功商业化。
近日,荣昌生物自主研发的靶向HER2 ADC维迪西妥单抗(RC48)获批上市,治疗晚期胃癌,成为首个国产上市的ADC新药。而后仅用两个月时间,就吸引了国际知名ADC开发公司Seagen进行合作。双方合作金额预付款2亿美元,里程碑金额达到24亿美元,刷新了国内Licensing-out交易的总金额上限。
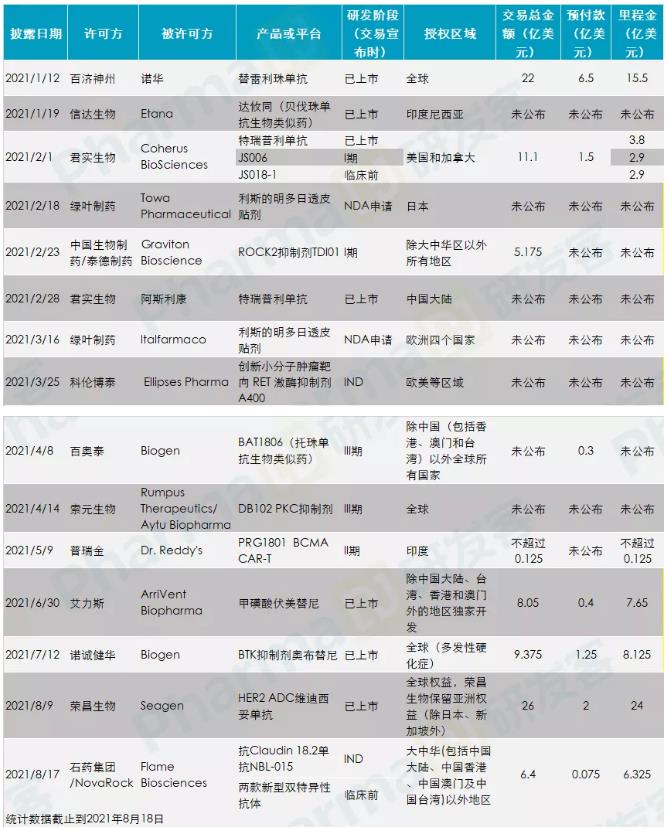
2021年以来,国内企业共发生15项对外授权(Licensing-out)交易,其中仅有1项君实生物和阿斯利康的合作是国内市场推广的交易,其余14项均是授权产品在国外的研发和商业化权益。
值得一提的是,授权的区域大部分是北美、欧洲以及除大中华区以外的全球地区。全球(包含除大中华区以外所有地区)的交易有8项,4项欧美市场交易,足见国内创新药企的自主研发实力已愈加受到国外企业的认可。
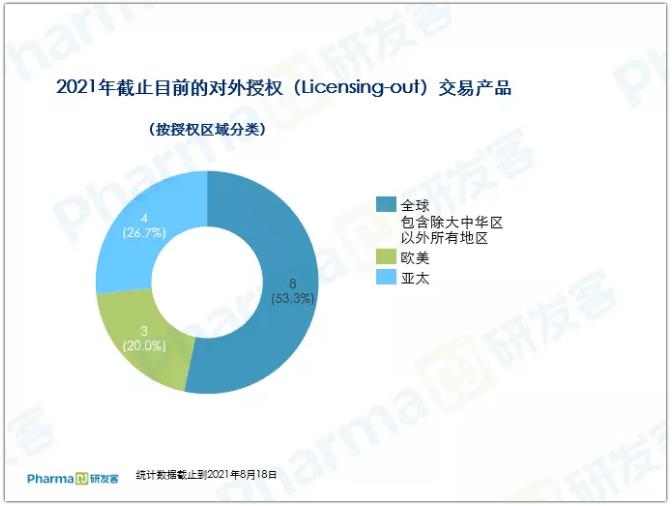
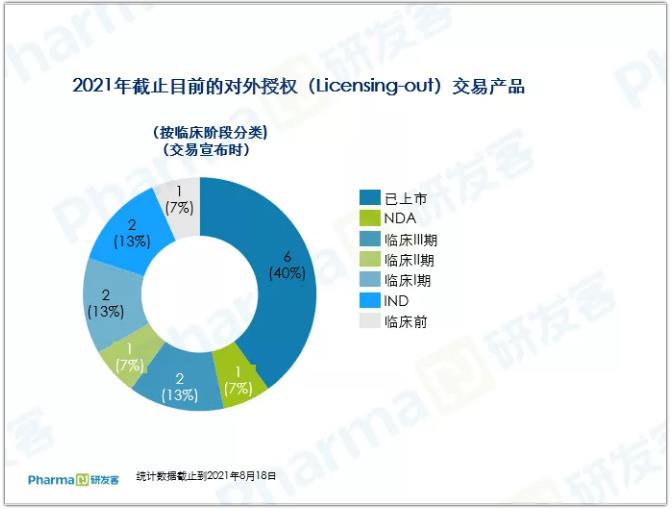
成功出海药物多数已上市
PD-1、ADC刷新交易
15项对外授权交易,共涉及15个产品,其中有6款已获批上市,处于临床中后期阶段的药物占据了近七成。其中两款PD-1单抗药物占有席位,分别是百济神州的替雷利珠单抗和君实生物的特瑞普利单抗。
百济神州与诺华在年初达成合作,将替雷利珠单抗在美国、加拿大等多个国家的开发、生产与商业化权益授权诺华,交易的总金额仅次于荣昌生物与Seagen,但首付款6.5亿元仍占据国内Licensing-out交易的首位。
君实生物有两项Licensing-out交易,先是将特瑞普利单抗、JS006和JS018-1在美国和加拿大的开发和商业化权益授权给了Coherus BioSciences,总额高达11.1亿美元,而后将特瑞普利单抗在中国部分适应症的独家推广权授权给了阿斯利康。
在此之前,PD-1单抗成功出海的案例已不鲜见。信达生物在2015年就与礼来合作开发信迪利单抗,并在2020年扩大合作,礼来获得信迪利单抗在中国以外地区的独家许可。
目前的国内公司在国外从注册开发、到实现全球商业化的经验尚不成熟,与跨国药企的合作可以帮助实现产品商业利益的最大化。
同样的逻辑在荣昌生物和Seagen的合作中也得到体现,与Seagen合作后,交易的资金可以帮助荣昌生物进行RC48进一步拓展适应症开发。
另一方面,Seagen选择荣昌生物进行合作,可以填补管线中HER2靶点的空白,且两家公司ADC技术类似,都是以可裂解mc-vc-PABC连接子和甲基澳瑞他汀E(MMAE)作为化学药组分,产品的对接没有技术壁垒。
不仅如此,能够吸引Seagen进行合作,RC48也有自己的实力。人表皮生长因子2(HER2)在乳腺癌、胃癌等多种肿瘤类型中过表达或扩增。全球已上市的HER2靶向ADC药物,不论是第二代的T-DM1.还是第三代ADC代表药物DS-8201a,首个获批适应症都是乳腺癌,国内申报HER2靶点的ADC药物有21项,大部分首选的适应症是乳腺癌。
荣昌生物在国内首个选择的适应症是胃癌,第二个近期递交NDA申请的是尿路上皮癌,除了考虑到胃癌是中国的第二大肿瘤,也避开了与DS-8201a和T-DM1的直接竞争。更重要的是RC48不论是在HER2阳性胃癌还是尿路上皮癌的表现都很亮眼。
根据2021年ASCO会议上公布的数据,RC48单药治疗HER2阳性局部晚期或转移性尿路上皮癌的客观缓解率(ORR)为50%,疾病控制率(DCR)为76.6%;与特瑞普利单抗联合治疗不限HER2状态的尿路上皮癌ORR达到100%。联合治疗的探索,进一步提高了RC48的临床价值。
小分子药物崭露头角
在小分子领域,诺诚健华表现优异,与Biogen达成的交易预付款1.25亿美元,里程碑金额达8.125亿美元,总交易金额9.375亿美元,在截止目前2021年Licensing-out交易中排名第四,小分子位列第一。交易的内容是将奥布替尼治疗多发性硬化症(MS)的除中国以外区域的权益授权给Biogen,诺诚健华保留了肿瘤的开发权利。
奥布替尼是一款BTK抑制剂,在国内已获批用于治疗复发/难治慢性淋巴细胞白血病(R/R CLL)/小淋巴细胞淋巴瘤(R/R SLL)、以及复发/难治套细胞淋巴瘤 (R/R MCL)两项适应症。在多发性硬化症领域,奥布替尼已进行到了临床II期。
另一项已上市产品交易是三代EGFR-TKI药物伏美替尼,已获批用于治疗EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌。6月30日,艾力斯与ArriVent达成合作,将伏美替尼在海外市场的开发及商业化权利License out给后者。
在小分子药物中,绿叶制药半年内共发生2项对外授权交易,分别将利斯的明多日透皮贴剂在日本和欧洲四个国家的权益授权给了Towa Pharmaceutical和Italfarmaco。利斯的明多日透皮贴剂是一款阿尔茨海默病治疗药,其上市申请已通过了欧盟非集中审评程序。
生物类似药受海外公司青睐
2021年上半年的Licensing-out交易中还有两款生物类似药,可见国内生物类似药产品的研发质量已逐步在国际收到认可。
2021年1月,信达生物与Etana公司达成合作,后者获得贝伐珠单抗生物类似药(达攸同)在印度尼西亚的独家许可。而在2020年1月,信达生物就已将达攸同在美国和加拿大的商业化权益授权给了Coherus BioSciences,随后在2020年6月17日,达攸同获得NMPA批准上市。信达生物此举将进一步扩大达攸同的商业化利益。
另一款生物类似药发生在百奥泰和Biogen之间,涉及产品是BAT1806.一款靶向IL-6R的托珠单抗生物类似药,正在开展III期临床。4月8日,百奥泰与Biogen签订协议,后者获得除中国(包括香港、澳门和台湾)以外全球所有国家的注册、生产和商业化相关的独占权利。值得一提的是,今年Biogen两度与国内企业合作。
附件:
截至目前2021年Licensing-out交易

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-07-04
2025-07-04
 34
34

 产业资讯
产业资讯
 2025-07-04
2025-07-04
 32
32

 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2025-07-04
2025-07-04
 35
35