 产业资讯
产业资讯
 药融圈
药融圈  2021-10-11
2021-10-11
 4401
4401
据不完全统计,至少还有16款药物将在今年第四季度迎来FDA首次批准(详见下表),其中小分子化学药占9款,适应症涉及肿瘤、自身免疫性疾病、罕见病等。
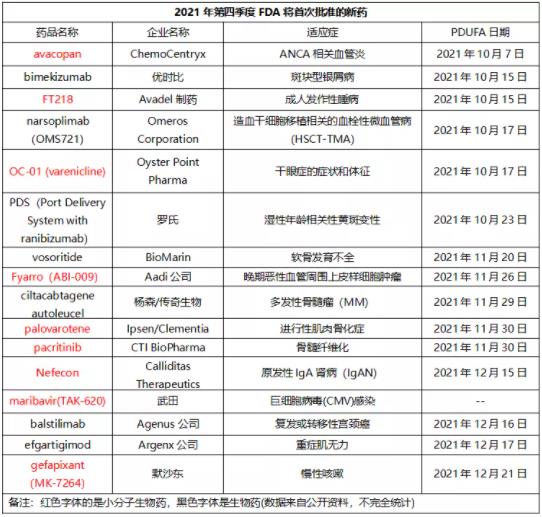
1.avacopan
avacopan是一款口服小分子补体C5a受体抑制剂,今年9月在日本被批准用于治疗抗中性粒细胞胞浆自身抗体(ANCA)相关血管炎的两种主要类型:显微镜下多血管炎(MPA)和肉芽肿伴多血管炎(GPA)。在美国,avacopan治疗ANCA相关血管炎的PDUFA日期被推迟至2021年10月7日。
2.bimekizumab
bimekizumab是一种新型人源化单克隆IgG1抗体,能强效、选择性地中和IL-17A和IL-17F,已于今年8月在欧洲被批准用于治疗疗适合系统治疗的中度至重度斑块型银屑病成人患者。值得一提的是,bimekizumab在治疗中重度斑块型银屑病的3期临床研究中已被证实优于艾伯维Humira、强生Stelara、诺华Cosentyx。在美国,bimekizumab治疗中度至重度斑块型银屑病的BLA预计将在10月15日收到FDA的回复。
3.FT218
FT218是采用Avadel公司MicroPump控释技术开发的一种试验性每晚用药一次的羟丁酸钠制剂,用于治疗发作性睡病成人患者的严重日间嗜睡和猝倒。2021年3月,FDA受理该药治疗发作性睡病的NDA,PDUFA日期为2021年10月15日。
4.narsoplimab
narsoplimab是一款靶向甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP-2)的全人IgG4单克隆抗体,MASP-2是一种新的促炎蛋白靶点和补体系统凝集素途径的效应酶。2021年1月,FDA受理该药治疗造血干细胞移植相关的血栓性微血管病(HSCT-TMA)的BLA,且授予该申请优先审查资格,但2021年5月FDA将该药的审查日期推迟至2021年10月17日。
5.OC-01
OC-01 (varenicline)鼻喷雾剂是多剂量包装、不含防腐剂的高选择性胆碱能激动剂鼻喷雾剂,用以治疗干眼症和神经营养性角膜病变的症状和体征。2020年12月,Oyster Point Pharma向FDA提交了OC-01 治疗干眼症症状和体征的NDA,PDUFA日期为2021年10月17日。值得一提的是,今年8月,箕星药业与Oyster Point Pharma达成独家许可及合作协议,获得该药以及OC-02 (simpinicline)鼻喷雾剂在大中华区开发和商业化权益。
6.PDS
PDS是一种使用独特端口递送系统给药的雷珠单抗疗法,能够在患者眼中植入一个可以定期补充药物的移植体,其关键性3期临床试验表明:在超过98%的湿性AMD患者中,PDS能够将治疗间隔时间延长至6个月,并提供与每月注射雷珠单抗相当的视力结果。2021年6月,罗氏宣布FDA已受理PDS治疗湿性年龄相关性黄斑变性的BLA,且授予该BLA优先审评资格。若获批,PDS将成为首个能够定期补充给药的眼部移植体疗法。
7.vosoritide
vosoritide是一种从天然人肽中衍生出来的C型利钠肽(CNP)类似物,是一种有效的软骨内骨化刺激剂,通过与特定受体结合,启动抑制过度活跃的FGFR3通路的细胞内信号。今年8月,该药在欧洲被批准用于治疗从2岁开始、直至生长板闭合的软骨发育不全儿童患者。在美国,该药正在接受审查,PDUFA目标日期为2021年11月20日。
8.Fyarro
Fyarro(ABI-009)是西罗莫司(sirolimus)白蛋白结合型纳米颗粒注射用混悬液,西罗莫司是一种mTOR抑制剂。与已上市的mTOR抑制剂相比,Fyarro具有更优越的PK特性、更宽的治疗窗、更高的肿瘤组织药物暴露量、更强的靶细胞抑制作用以及更理想的安全性。2021年7月,FDA受理Fyarro治疗晚期恶性血管周围上皮样细胞肿瘤的NDA,且授予该申请优先审查,PDUFA日期为2021年11月26日。此外,今年1月,亿腾景昂药业与Aadi公司达成独家授权合作,获得Fyarro在大中华区(中国内地、香港、澳门和台湾)的开发及商业化权益。
9.Cilta-cel
Cilta-cel是一种具有差异性结构的CAR-T细胞疗法,包含一个4-1BB共刺激结构域和两个靶向BCMA的抗体结构域,具有促进CD8阳性T细胞扩增的能力。2017年12月,杨森与传奇生物达成全球独家许可和合作协议,共同开发和商业化cilta-cel。
2021年5月,杨森宣布FDA已受理Cilta-cel治疗多发性骨髓瘤(MM)的BLA,并授予该BLA优先审查。Cilta-cel治疗MM的关键性1b/2期研究CARTITUDE-1结果显示:中位随访时间12.4个月,Cilta-cel的ORR达到97%,而且随着时间的推移,患者的缓解程度进一步加深,67%的患者达到严格的完全缓解。
10.Palovarotene
Palovarotene是益普生(Ipsen)以13亿美元收购Clementia Pharmaceuticals获得的一款选择性RARγ抑制剂,被开发用于治疗进行性肌肉骨化症(FOP)、多种骨软骨瘤以及干眼病等疾病,其治疗FOP的全球多中心3期临床试验MOVE数据显示:与自然病史研究中未接受治疗的患者相比,接受palovarotene治疗的患者平均每年新增的异位骨化体积减少62%(p=0.0292)。
2021年6月,FDA受理Palovarotene治疗FOP的NDA,且授予该申请优先审查资格,PDUFA日期为2021年11月30日。若获批,palovarotene将成为世界上首款治疗FOP的疗法。
11.Pacritinib
Pacritinib是一款特异性抑制JAK2、IRAK1和CSF1R的口服抑制剂,因不抑制JAK1活性避免了抑制JAK1带来的潜在副作用,具有治疗骨髓纤维化、急性髓系白血病(AML)、骨髓增生异常综合征(MDS)、慢性粒单核细胞白血病(CMML)和慢性淋巴细胞白血病(CLL)等疾病的潜力。其治疗骨髓纤维化的一个2期临床试验与两个3期临床试验结果表明:在接受pacritinib治疗的患者中,29%的患者脾脏体积缩小了至少35%(Vs活性对照组3%),23%的患者总症状评分至少降低了50%(Vs活性对照组13%)。
2021年6月,FDA受理pacritinib用于治疗伴有严重血小板减少症的骨髓纤维化的NDA,且授予该申请优先审评资格,预计FDA将在今年11月30日前做出回复。
12.Nefecon
Nefecon是布地奈德的一种靶向释放口服制剂,通过采用Calliditas公司的TARGIT技术让药物在不被吸收的情况下通过胃肠道,只有达到小肠下部时才会被吸收。2021年4月,FDA受理Nefecon治疗原发性IgA肾病(IgAN)的NDA,并授予该NDA优先审查资格,PDUFA目标日期为2021年9月15日。由于FDA认为Calliditas后续递交的NeflgArd进一步数据分析是对NDA的重大修订,Nefecon的PDUFA日期被延迟,PDUFA日期被推迟至2021年12月15日。
13.maribavir
maribavir属于苯并咪唑核苷类药物,可靶向抑制巨细胞病毒(CMV)的UL97蛋白激酶,从而潜在影响CMV复制的几个关键过程,包括病毒DNA复制、病毒基因表达、衣壳化以及成熟衣壳从受感染细胞的细胞核中逃逸。其在难治性、有或无耐药性的CMV感染/疾病移植受者中开展的关键3期研究TAK-620-303结果显示:在研究第8周,接受抗病毒治疗、有或无耐药性、CMV疾病/感染的移植受者中,maribavir治疗组有55.7%的患者实现确认的CMV病毒血症清除,而常规治疗组为23.9%,达到主要研究终点。
2021年5月,武田宣布FDA受理maribavir治疗难治性、有或无耐药性CMV感染的NDA,且授予该申请优先审查。若获批,maribavir将成为第一个也是唯一一个用于移植受者治疗移植后R/R CMV感染的药物。
14.balstilimab
balstilimab是一种新型全人单克隆免疫球蛋白G4(IgG4),旨在阻断PD-1与其配体PD-L1和PD-L2的相互作用。2021年6月,FDA授予该药用于治疗化疗期间或之后疾病发生进展的复发性或转移性宫颈癌的优先审查资格,PDUFA日期为2021年12月16日。
15.efgartigimod
Efgartigimod是基于ABDEG Fc工程技术平台开发一款在研的抗体片段,是一种首创的新型IgG转运受体(FcRn)拮抗剂,FcRn在全身中都有广泛表达,阻断FcRn可降低IgG抗体表达水平,治疗已知由致病IgG抗体驱动导致的自身免疫性疾病。其治疗全身型重症肌无力(gMG)关键3期研究ADAPT的结果显示:efgartigimod治疗可显著改善gMG患者的力量和生活质量。
目前,该药正在美国接受审查,PDUFA日期为2021年12月17日。若获批,efgartigimod将成为第一个也是唯一一个获得监管批准的FcRn拮抗剂。
16.gefapixant
gefapixant(MK-7264)是一种口服、选择性P2X3受体拮抗剂,2021年3月,FDA受理该药用于治疗难治性慢性咳嗽(RCC)或不明原因慢性咳嗽(UCC)成人患者的NDA。若顺利,gefapixant将成为首个专门治疗RCC和UCC的药物。

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 31
31

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 34
34

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 34
34