 产业资讯
产业资讯
 Insight数据库
Insight数据库  2021-10-27
2021-10-27
 4044
4044
10 月 25 日,阿斯利康宣布,其 PD-L1 单抗度伐利尤单抗(Imfinzi)联合化疗一线治疗晚期胆道癌(BTC)的 III 期临床 TOPAZ-1 在中期分析中达到了总生存期(OS)主要终点。
这是首个在一线胆道癌全球 III 期临床中取得积极结果的免疫疗法。2020 年 12 月,Imfinzi 已获 FDA 授予治疗 BTC 的孤儿药资格认定。

来自:阿斯利康官网
TOPAZ-1 是一种随机、双盲、安慰剂对照全球多中心 III 期临床试验,评估 Imfinzi 联合化疗(吉西他滨+顺铂)相较于安慰剂联合化疗一线治疗不可切除的晚期或转移性 BTC 患者的疗效和安全性。该试验在全球纳入 685 名患者,主要终点为总生存期(OS),关键次要终点包括无进展生存期(PFS)、客观缓解率(ORR)以及安全性。
在预先确定的中期分析中,与单独化疗相比 Imfinzi 联合疗法表现出具有统计学意义和临床意义的总生存(OS)益处,达到了主要终点;同时在 PFS 和 ORR 也均得到了显著改善。安全性方面,Imfinzi 联合化疗耐受性良好,与对照组相比具有相似的安全性,并且与单独化疗相比,不会增加因不良事件导致的停药率。
阿斯利康表示,具体临床数据后续将在随后的医学会议中公布,并与监管机构沟通。
BTC 是发生在胆管和胆囊中的一种罕见的侵袭性癌症,全球范围内每年约有 210,000 人被诊断出患有 BTC。这些患者确诊时大多已进展至晚期,预后较差,5 年生存率仅在 5%~15% 左右。当前的一线标准治疗仍为吉西他滨联合顺铂,mOS 约 12 个月。
然而,目前 FDA 仅批准了 3 款胆道癌靶向药,而未有免疫疗法获批。这三款胆管癌治疗药物都在 2020 年及 2021 年才刚刚获批,其中两款为 FGFR 抑制剂,信达/Incyte 的 Pemigatinib 和联拓/BrigeBio 的 Infigratinib;一款为 IDH1 抑制剂艾伏尼布,由 Agios Pharmaceuticals 开发,基石药业引进。目前 Pemigatinib 和艾伏尼布已经在国内递交上市申请。
而免疫疗法在胆道癌进展不算顺利,今年默克的 PD-L1/TGFβ 双特异性融合蛋白 M7824 在这一适应症上刚刚惨遭一线二线二连败。据Insight 数据库 统计,除度伐利尤单抗外,国外默沙东 Keytruda、默克 M7824,国内天晴 TQB2450、康宁杰瑞/思路迪的恩沃利单抗也启动了针对胆管癌的 2/3 期临床或 3 期临床,君实的特瑞普利单抗则联合仑伐替尼和化疗用于胆管癌新辅助治疗。
近期,Imfinzi 在关键临床试验中取得的突破不止胆道癌。10 月 15 日,阿斯利康刚刚宣布在一线肝癌 III 期临床 HIMALAYA 研究中达到了 OS 主要终点。该试验是一项随机、开放标签、全球多中心 III 期临床,评估了 Imfinzi 单药、Imfinzi 联用 CTLA-4 单抗 tremelimumab 与索拉非尼相比一线治疗肝细胞癌的疗效。试验共招募了 1324 名患者。免疫联合疗法显示出了具有统计学意义和临床意义的总生存(OS)益处,且数值趋势上显示出耐受性改善。
该试验中使用被称为 STRIDE 方案的给药方式,单次高剂量给药 Tremelimumab 300mg + Imfinzi 1500mg,随后每 4 周一次给药 Imfinzi。该组合显示出良好的安全性,且 Tremelimumab 的使用并未带来肝毒性的增加。
阿斯利康肿瘤研发副总裁 Susan Galbraith 表示,HIMALAYA 研究是双重免疫疗法首次在不可切除肝癌患者一线治疗中提高了总生存期(OS)。
根据阿斯利康半年报,Imfinzi 在 2021H1 获得 12 亿美元收入,增长 18%。目前,该药获批的适应症包括不可切除 III 期 NSCLC、广泛期小细胞肺癌以及膀胱癌,随着适应症的拓展势必获得更强的增长驱动力。
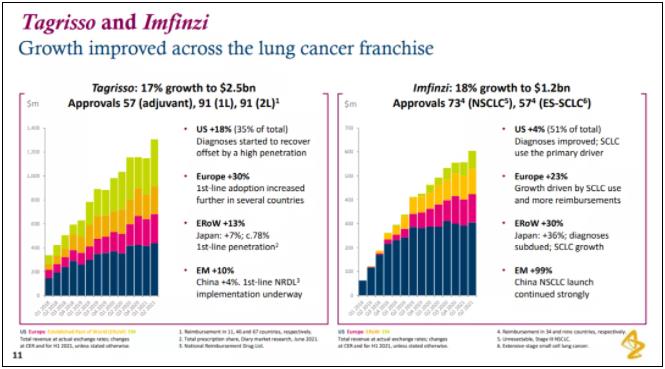
来自:阿斯利康半年报 PPT
同时,在 2021H2,阿斯利康还将递交 Imfinzi 联合 CTLA-4 一线治疗 NSCLC的 sBLA;2022H1 预计提交两项适应症 sBLA,针对 III 期 NSCLC 以及联合 CTLA-4 治疗肝细胞癌;2022H2 预计递交 1L NSCLC、宫颈癌以及胆道癌的 sBLA。

来自:阿斯利康半年报 PPT

 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-23
2025-06-23
 47
47

 产业资讯
产业资讯
 支点财经
支点财经  2025-06-23
2025-06-23
 47
47

 产业资讯
产业资讯
 药视声
药视声  2025-06-23
2025-06-23
 49
49