 产业资讯
产业资讯
 米内网
米内网  2021-11-08
2021-11-08
 2593
2593
摘要
10月CDE共承办药品注册申请915件
7个存量品种首次有企业申报一致性评价
2款重磅1类新药首次申报上市
泽璟生物甲苯磺酸多纳非尼片新适应症报产
17个品种申请仿制,2个品种申请进口5.2类
微芯糖尿病1类新药西格列他钠片获批上市
6个首仿品种获批,2个存量品种迎首家过评
CDE总体承办情况
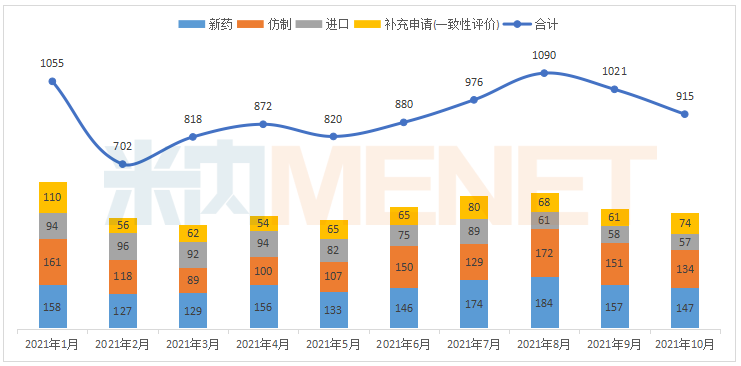
据米内网MED2.0中国药品审评数据库统计,2021年10月CDE共承办药品注册申请915件。
2021年1月-10月CDE承办药品注册申请情况(按受理号计)
一致性评价补充申请承办情况
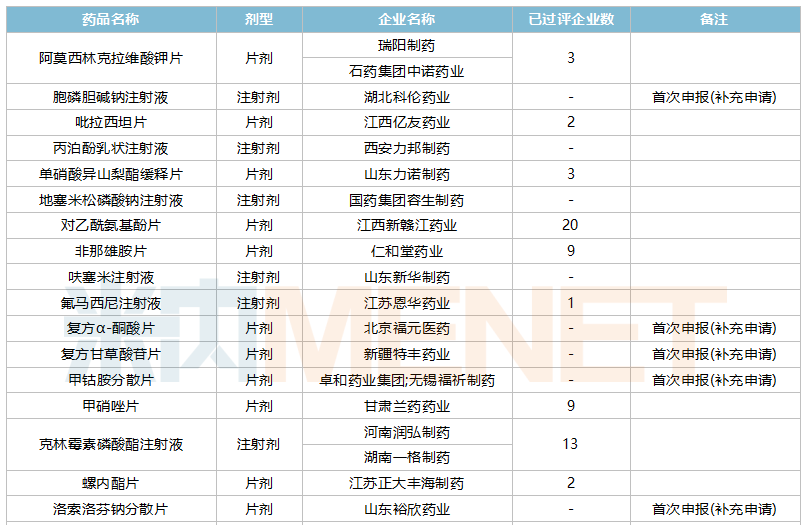
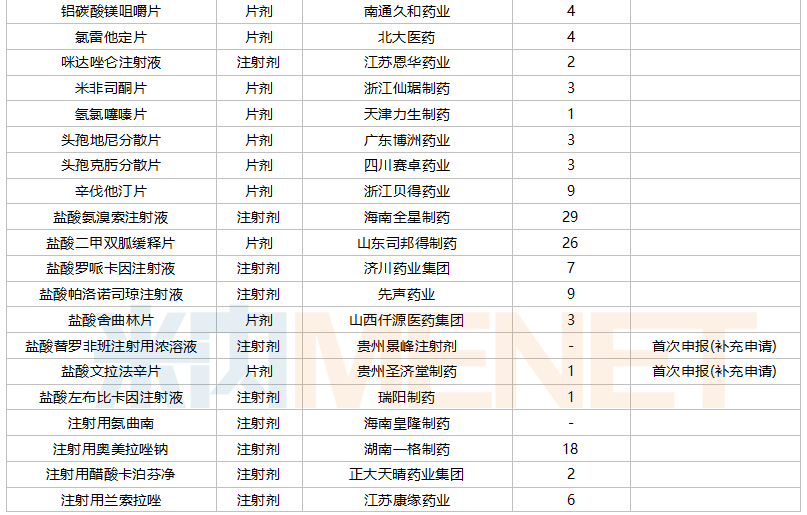
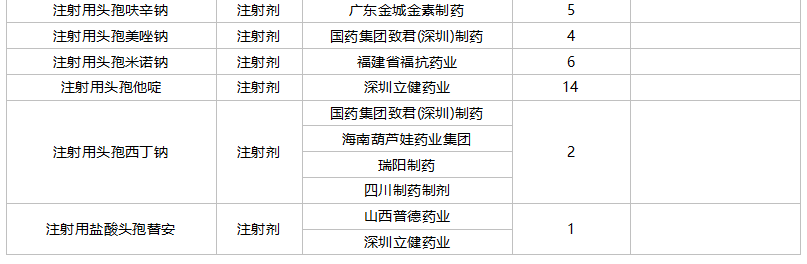
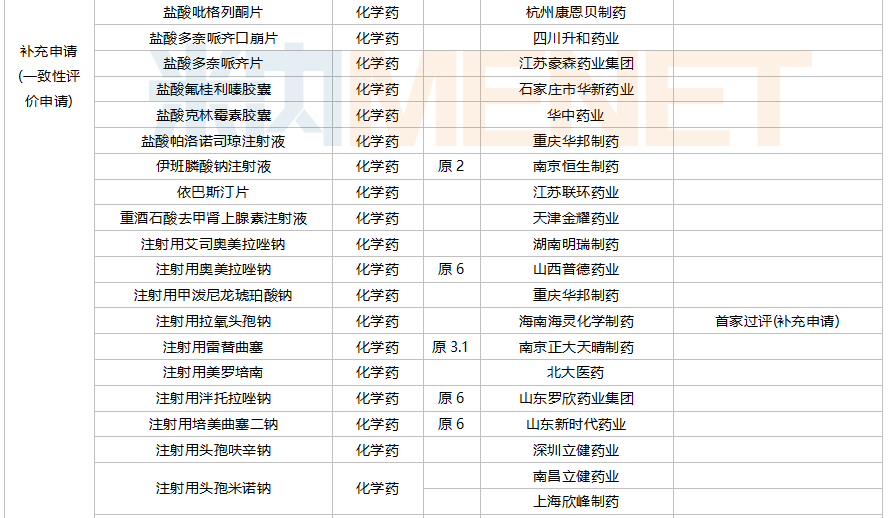
2021年10月,43个品种的一致性评价补充申请获CDE承办。7个品种为首次提交一致性评价补充申请:胞磷胆碱钠注射液、复方α-酮酸片、复方甘草酸苷片、甲钴胺分散片、洛索洛芬钠分散片、盐酸替罗非班注射用浓溶液、盐酸文拉法辛片。详细情况见下表:
10月CDE补充申请(一致性评价)品种承办情况
新药申请承办情况
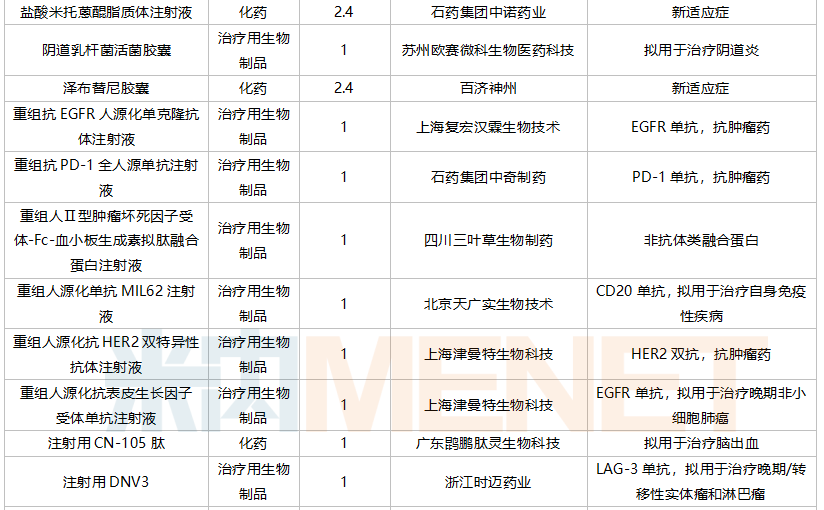
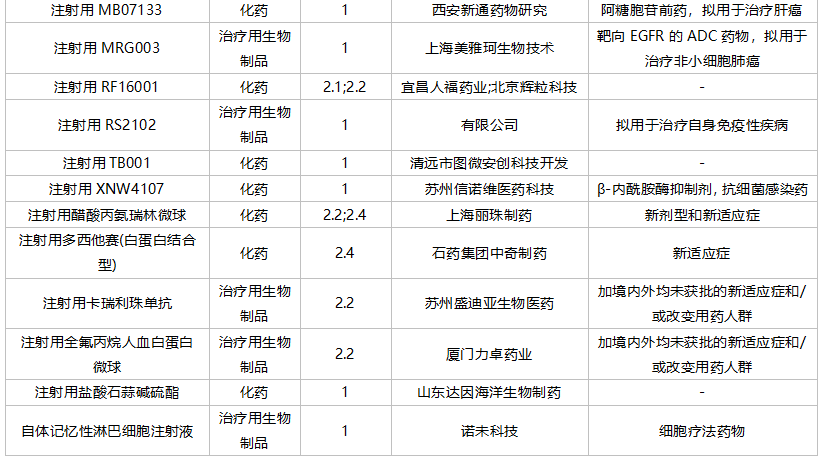
2021年10月,104个品种的新药申请获CDE承办。其中1类新药有76个,2类改良型新药有22个,3.3类生物类似药2个。
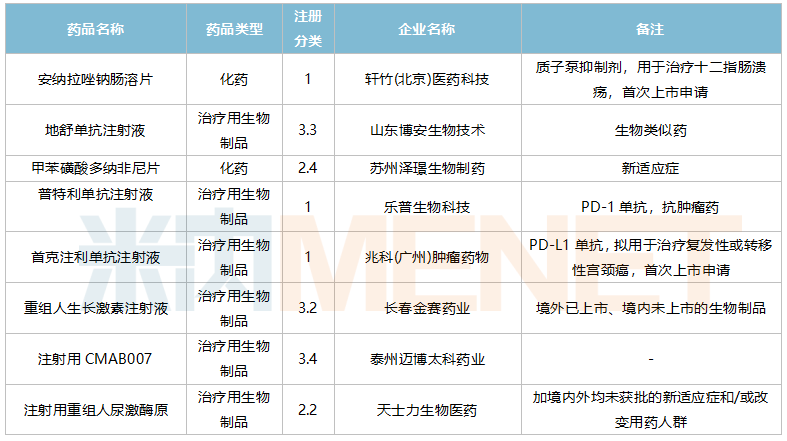
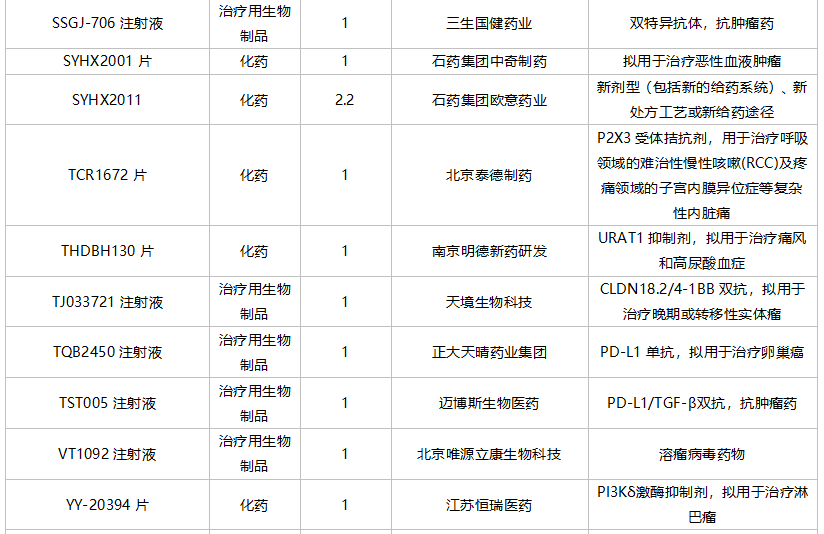
轩竹(北京)医药科技提交质子泵抑制剂安纳拉唑钠肠溶片上市申请。乐普生物科技和赵科肿瘤药物各有一款PD-(L)1单抗申报上市。苏州泽璟生物提交甲苯磺酸多纳非尼片新适应症上市申请。
10月国内新药上市申请承办情况
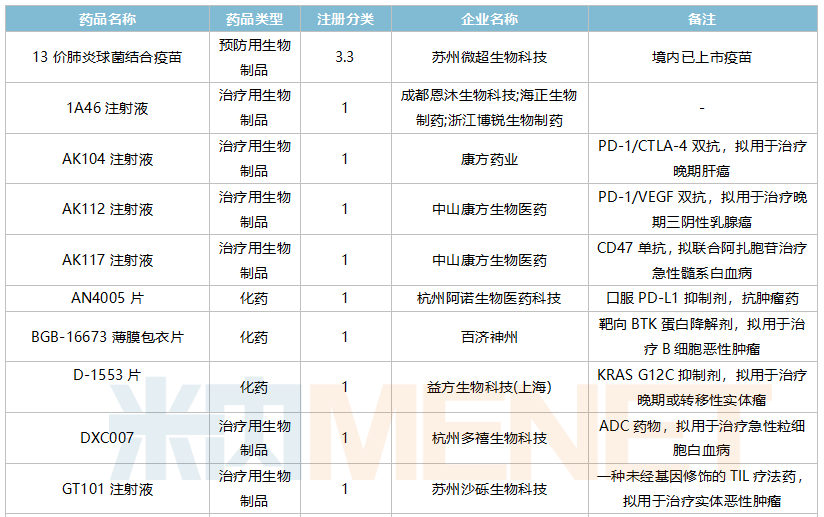
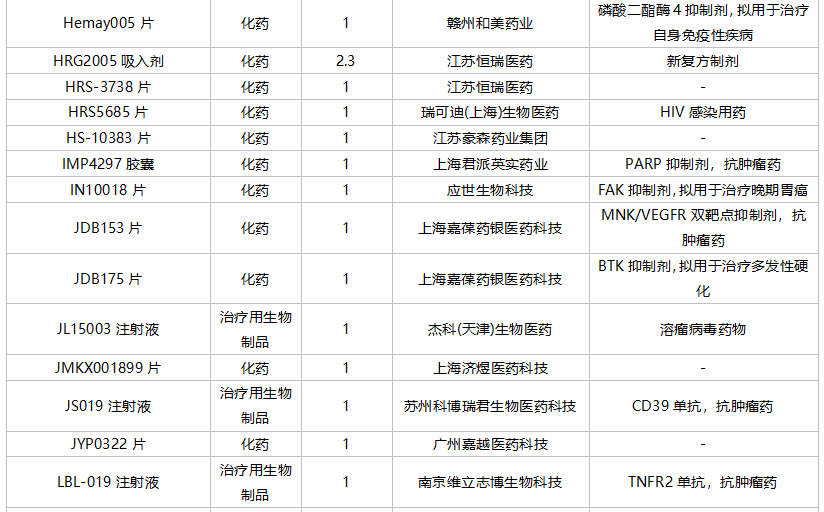
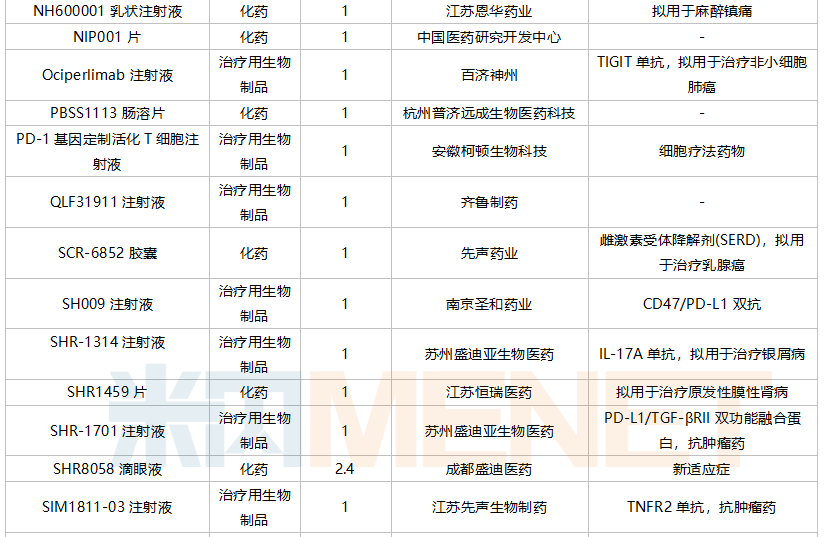
10月国内新药临床申请承办情况

仿制申请承办情况
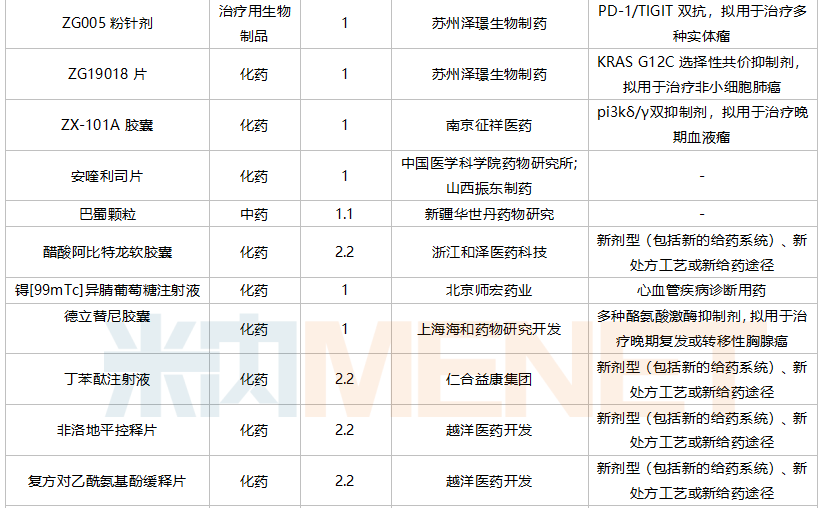
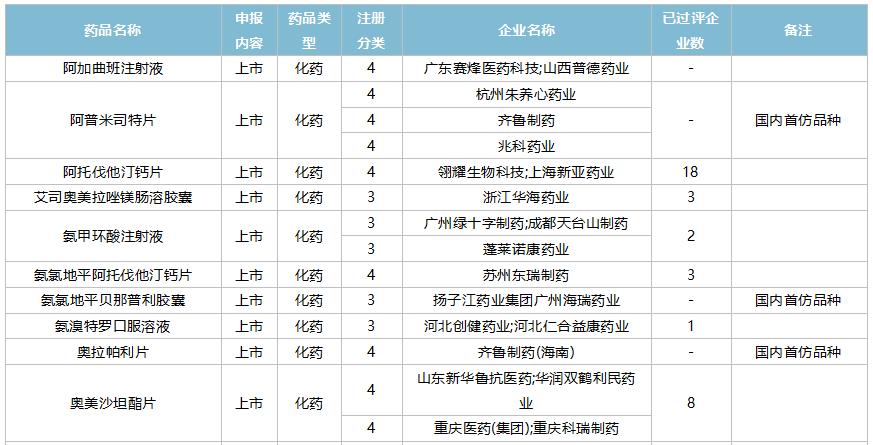
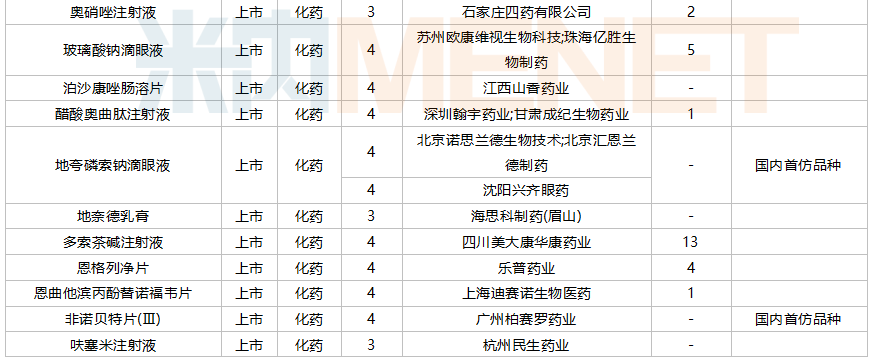
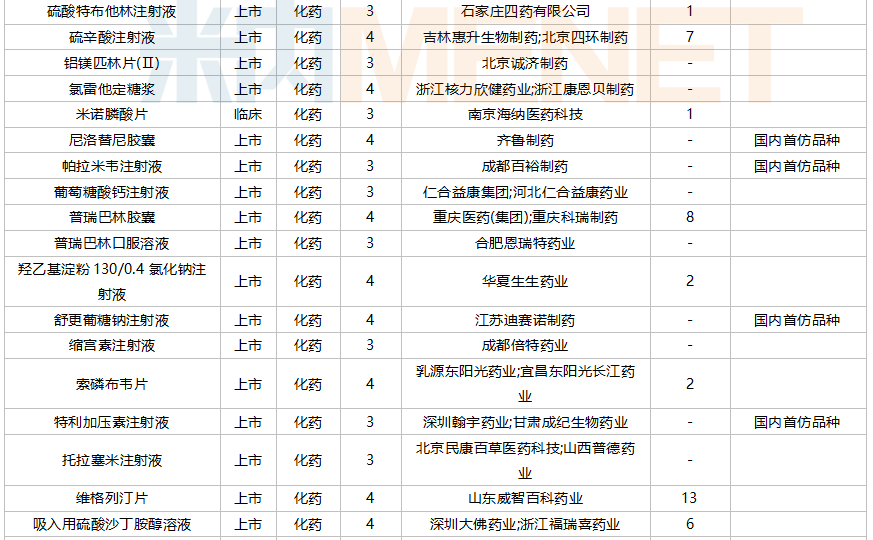
2021年10月,88个品种的仿制申请获CDE承办,其中17个品种暂无国产获批:阿普米司特片、氨氯地平贝那普利胶囊、奥拉帕利片、地夸磷索钠滴眼液、非诺贝特片(Ⅲ)、氟康唑干混悬剂、氟哌啶醇口服溶液、富马酸二甲酯肠溶胶囊、环磷酰胺胶囊、赖氨洛芬注射液、磷酸奥司他韦干糖浆、尼洛替尼胶囊、帕拉米韦注射液、舒更葡糖钠注射液、特利加压素注射液、盐酸可乐定缓释片、盐酸溴己新口服液。其中阿普米司特片有三家企业布局,详细情况见下表:
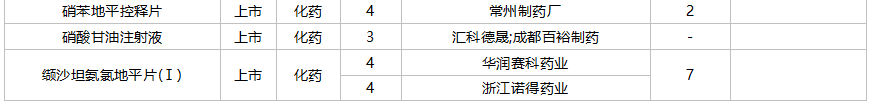
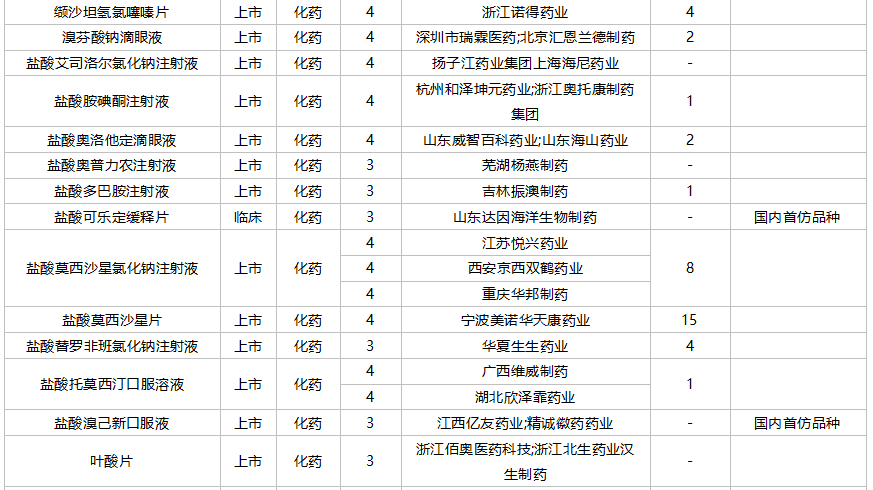
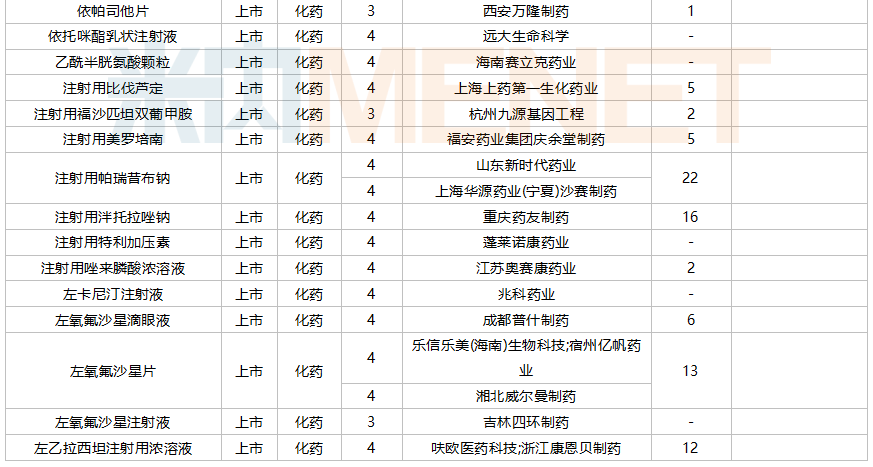
10月国内仿制申请承办情况

进口申请承办情况
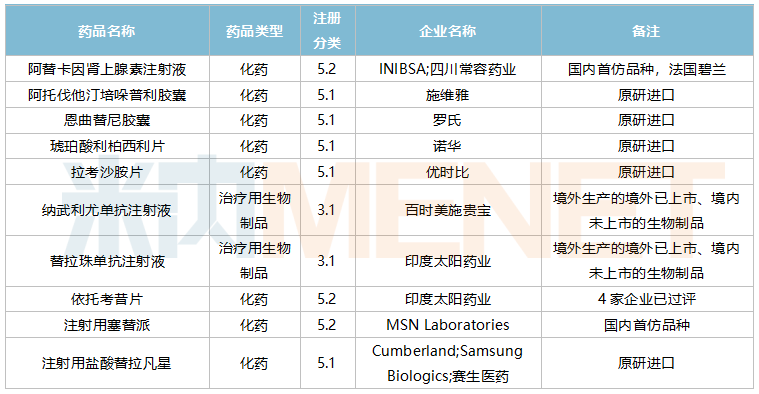
2021年10月,36个品种的进口申请获CDE承办。其中1类新药有15个,2类改良型新药有10个,5.1类进口原研药有6个,5.2类进口仿制药有3个。5.2类进口仿制药中阿替卡因肾上腺素注射液、注射用塞替派暂无国产获批。
10月进口上市申请承办情况
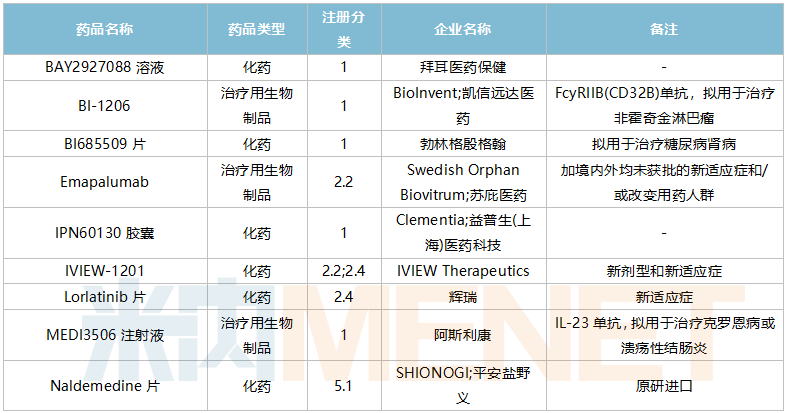
10月进口临床申请承办情况

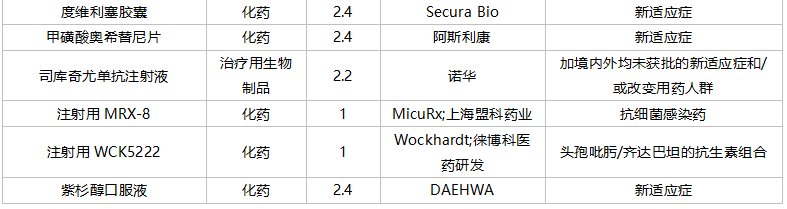
获批情况
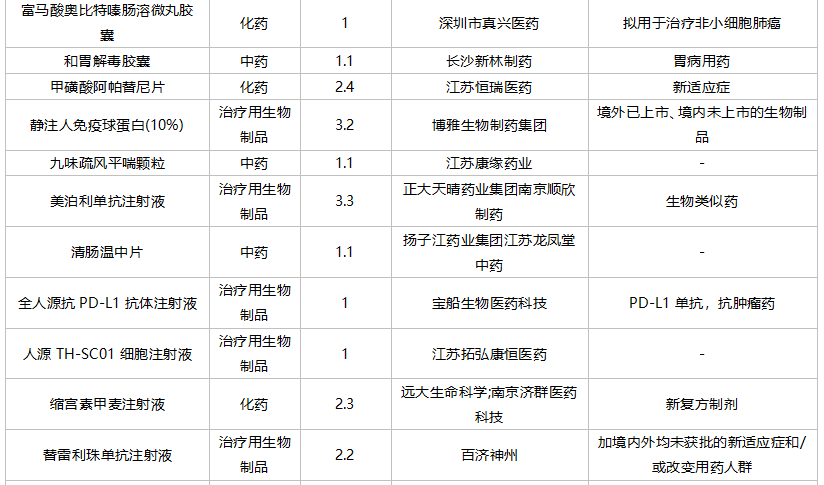
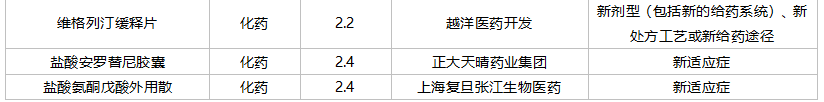
2021年10月,成都微芯药业的糖尿病1类新药西格列他钠片获批上市。南京优科制药以及上海谊众生物各有一款改良型新药获批。
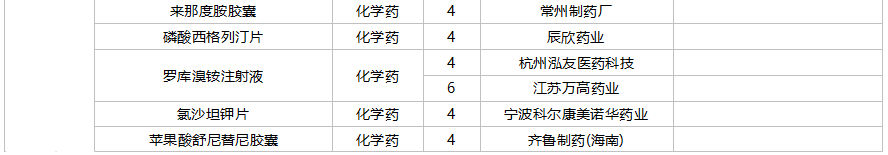
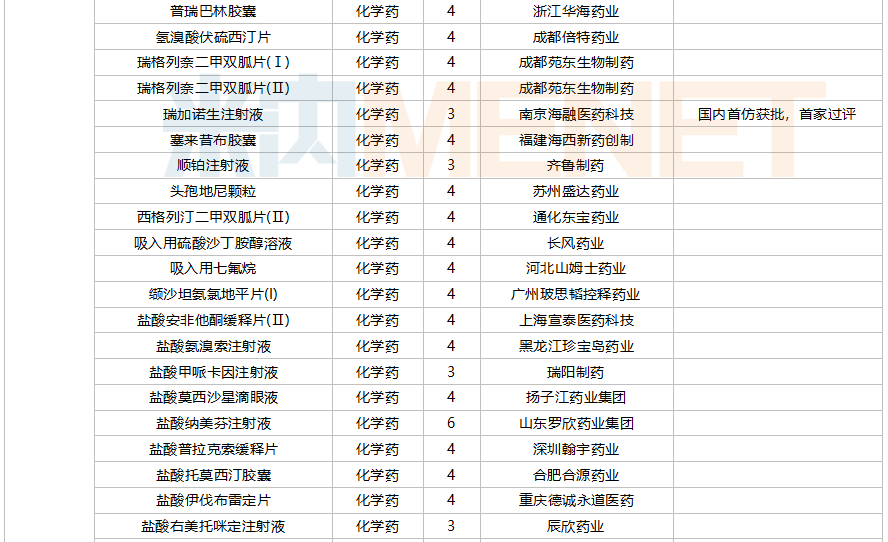
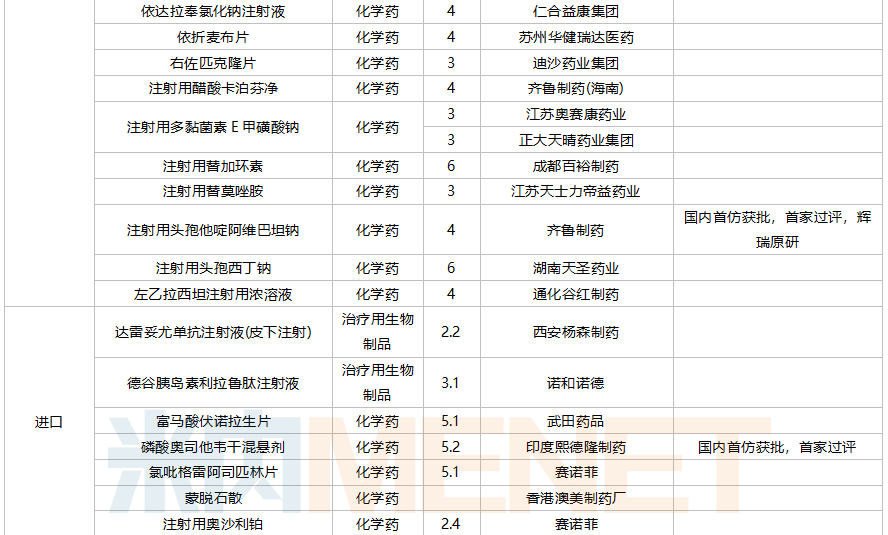
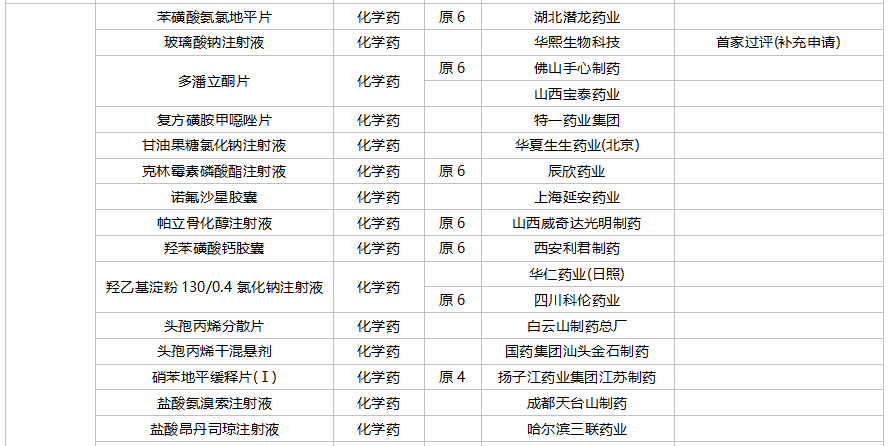
59个仿制药获批(含进口5.2类),苯扎贝特缓释片(江苏天士力帝益药业)、枸橼酸莫沙必利颗粒(浙江亚太药业)、结构脂肪乳(20%)/氨基酸(16)/葡萄糖(13%)注射液(费森尤斯卡比华瑞制药)、瑞加诺生注射液(南京海融医药科技)、注射用头孢他啶阿维巴坦钠(齐鲁制药)、磷酸奥司他韦干混悬剂(印度熙德隆制药)等品种为国内首仿获批。
35个存量品种通过一致性评价,其中玻璃酸钠注射液(华熙生物科技)和注射用拉氧头孢钠(海南海灵化学制药)为首家企业过评。
10月上市申请品种及一致性评价品种获批情况
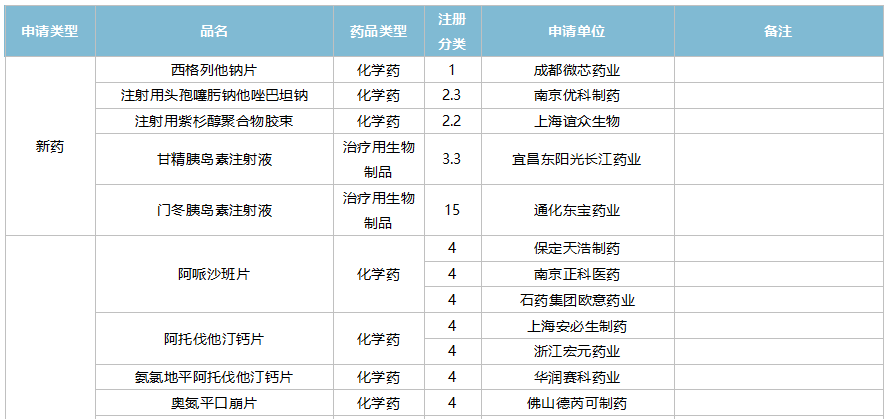


数据来源:米内网MED2.0药品审评数据库、CDE、NMPA;相关统计字段按药品名称统计,时间截至2021年10月31日;药物作用靶点以及适应症整理自公开资料。

 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-23
2025-06-23
 2
2

 产业资讯
产业资讯
 支点财经
支点财经  2025-06-23
2025-06-23
 2
2

 产业资讯
产业资讯
 药视声
药视声  2025-06-23
2025-06-23
 2
2